
广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
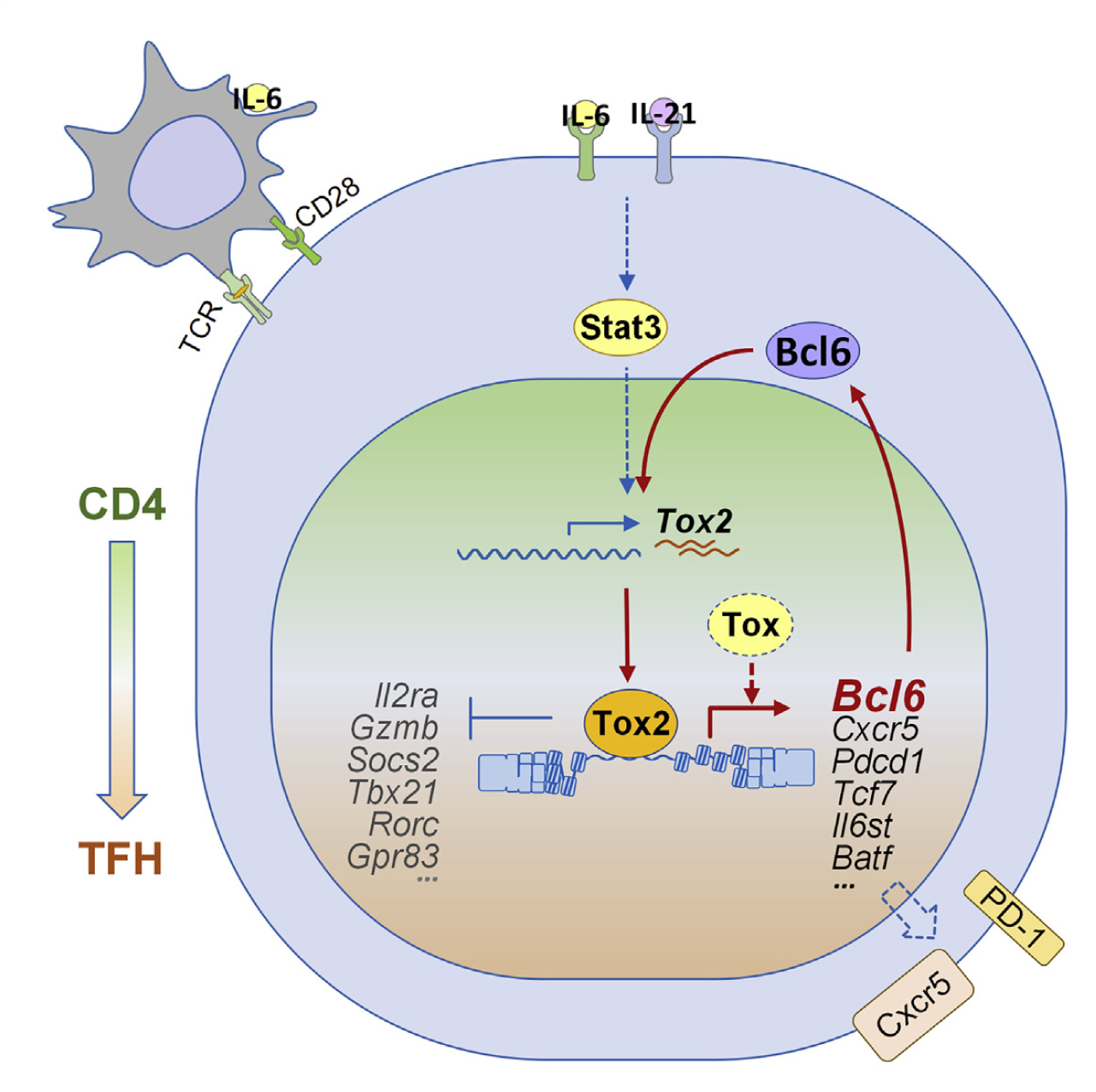
转录因子Tox2通过调节染色质的可及性驱动T滤泡辅助细胞的发育
日期:2020-03-14 标签:转录因子,T滤泡

摘要:
T滤泡辅助细胞(Tfh)是生发中心(GC)形成所需的专门效应CD4 + T细胞亚群。Bcl6是Tfh细胞中的强制性谱系转录因子。全基因组Bcl6差异基因表达分析表明,转录因子Tox2的异位表达驱动Bcl6表达和Tfh发育,在Tfh细胞分化中具有重要作用。全基因组ChIP-seq分析中,与Tfh细胞相关的Tox2结合位点(包括Bcl6)具有不同的功能。通过ATAC-seq检测表明Tox2结合与这些位点的染色质可及性增加有关。Tox2缺失小鼠表现出缺陷的Tfh分化,并且Tox2和相关转录因子Tox的抑制均阻碍了Tfh的分化。因此,Tox2-Bcl6轴构成了促进Tfh程序的转录前馈环。
01
Tfh细胞中Tox2的选择性表达
作者首先分析了几个数据集表明Bcl6在Tfh分化过程中直接驱动Tox2表达(补充数据)。为了弄清Tox2是否在Tfh细胞中选择性表达,作者分析Tox2基因座的表观遗传学特征,发现它在Tfh细胞中被活性染色质标记H3K4me3标记而没有被抑制性色氨酸标记H3K27me3标记,而在体外和非Tfh细胞或其他T细胞谱系中则相反(图1A)。小鼠的Tfh细胞进行ATAC-seq分析表明与原始CD4 + T细胞相比,Tfh中Tox2基因座染色质可及性增加(图1B)。为了确认Tox2在Tfh细胞中选择性表达,对CD4 + CD44lo,non-Tfh,pre-Tfh和Tfh细胞进行了分类并通过qRT-PCR检测,发现Tox2的mRNA水平在CXCR5hiBcl6-RFPhi Tfh细胞中高表达(图1C),并且与Cxcr5,Bcl6和Pdcd1紧密相关(图1C)。另外补充数据中qRT-PCR结果显示IL-6和IL-21在明显诱导Tox2表达,而IL-21阻断可增强Tox2表达,在Stat3或者Bcl6缺乏时Tox2 mRNA表达都降低。说明IL-6和IL-21诱导Tox2表达同时依赖于Stat3和Bcl6。
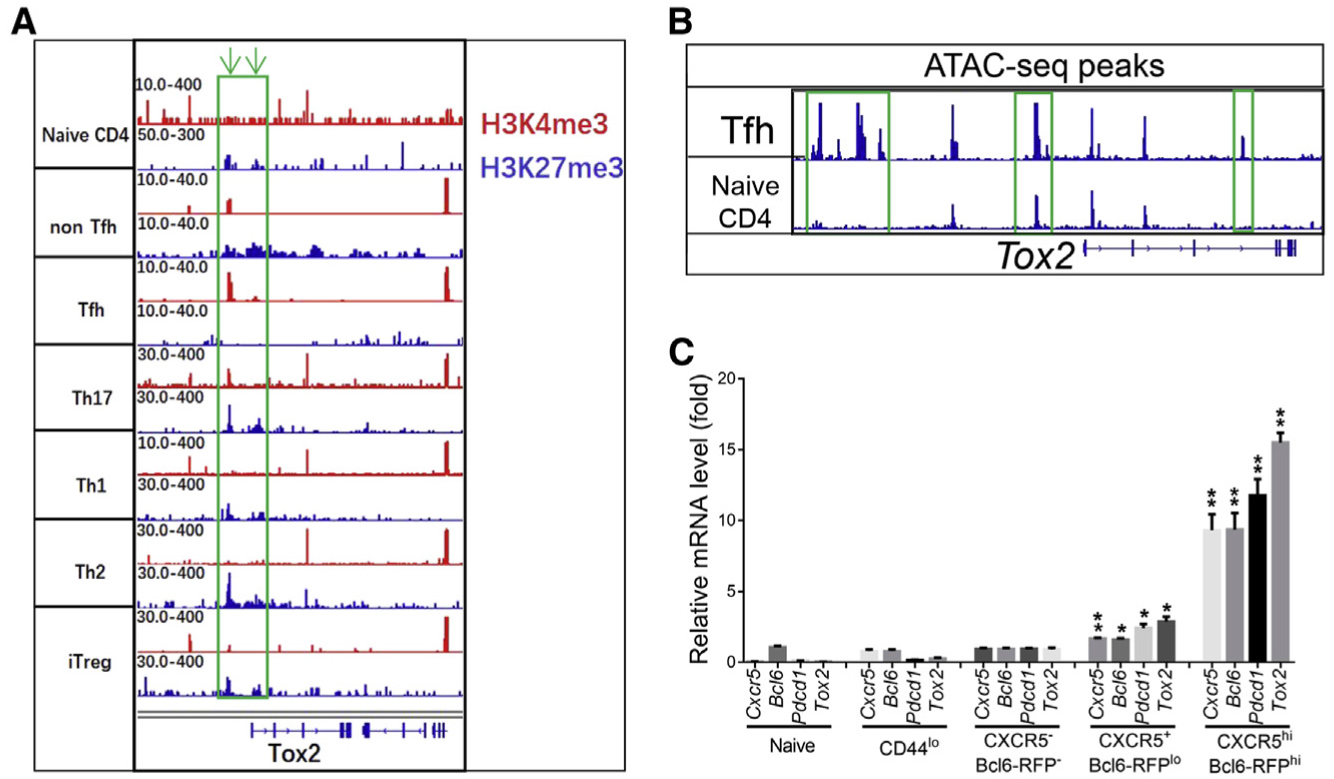
图1. Tox2在Tfh细胞中选择性表达
(A)在不同T细胞亚群的Tox2基因座上,全基因组组蛋白修饰(H3K4me3,激活性标记; H3K27me3,抑制性标记),数据集来自Gene Expression Omnibus数据库(登录号GEO:GSE52840和GEO:GSE14254)。
(B)Tfh细胞和纯净CD4 + T细胞在Tox2基因座处的平均ATAC-seq覆盖率。Tfh数据集是新生成的;CD4 + T细胞数据集来自Gene Expression Omnibus数据库(登录号GEO:GSE120532)。
(C)通过qRT-PCR测量Cxcr5,Bcl6,Pdcd1和Tox2的mRNA水平。
02
Tox2通过促进染色质重塑调节相关基因表达从而促进Tfh分化
(1)Tox2的表达促进Tfh分化(图略)
已有研究显示Tox2可以促进人NK细胞中Tbx21的表达,为了验证Tox2在CD4 + T细胞中是否具有相似的功能,作者构建了Tox2过表达的CD4 + T细胞,然后在中性和Th1分化条件下对细胞进行分选和培养。显示Tox2过表达使得Bcl6以及其他与Tfh相关的基因(包括Cxcr5,Il6st和Tcf7 )mRNA及蛋白质表达大量增加。然后,通过将Tox2转导的细胞或其对照细胞转移到受体小鼠中进行体内通过CFA中的鸡卵清蛋白(OVA)免疫进行免疫分析,表明Tox2转导的细胞中的Tfh细胞的频率显着增加,而且相应的Tfh分化分子CXCR5,PD-1和Bcl6的表达增强。
(2)Tox2调节Tfh相关基因的转录
为了深入了解Tox2调节Tfh分化的机制,作者进行了RNA-seq分析。与Th0条件相比,在Tfh中2,913个基因的表达变化超过1.5倍,Tox2过表达细胞在Th0和Tfh条件下,分别有1,605和1,311个基因的表达改变了1.5倍以上(图3A)。然后,作者选择在Tfh细胞中差异表达的已发表基因进行基因集富集分析(GSEA)。首先评估了IL-6信号在Tfh发育过程中的作用,并观察到Tox2-RV-GFP + CD4 + T细胞对Tfh细胞中促进的基因组显着富集(图3B),在Tfh细胞中受阻的基因在空对照细胞中更富集。通过不同的表达基因(DEG)和GSEA分析,Tox2促进了许多Tfh标志基因(Bcl6,Cxcr5,Pdcd1等)的表达,并抑制了许多在Tfh细胞中被抑制的基因(Gzmb,IL2ra等)的表达(图3C)。同时,Th1相关基因(Il12rb2和Tbx21)和Th17相关基因(Il17a,Il17f,Ahr和Rorc)在Th0和Tfh样条件下mRNA表达中也被Tox2抑制(图3C)。
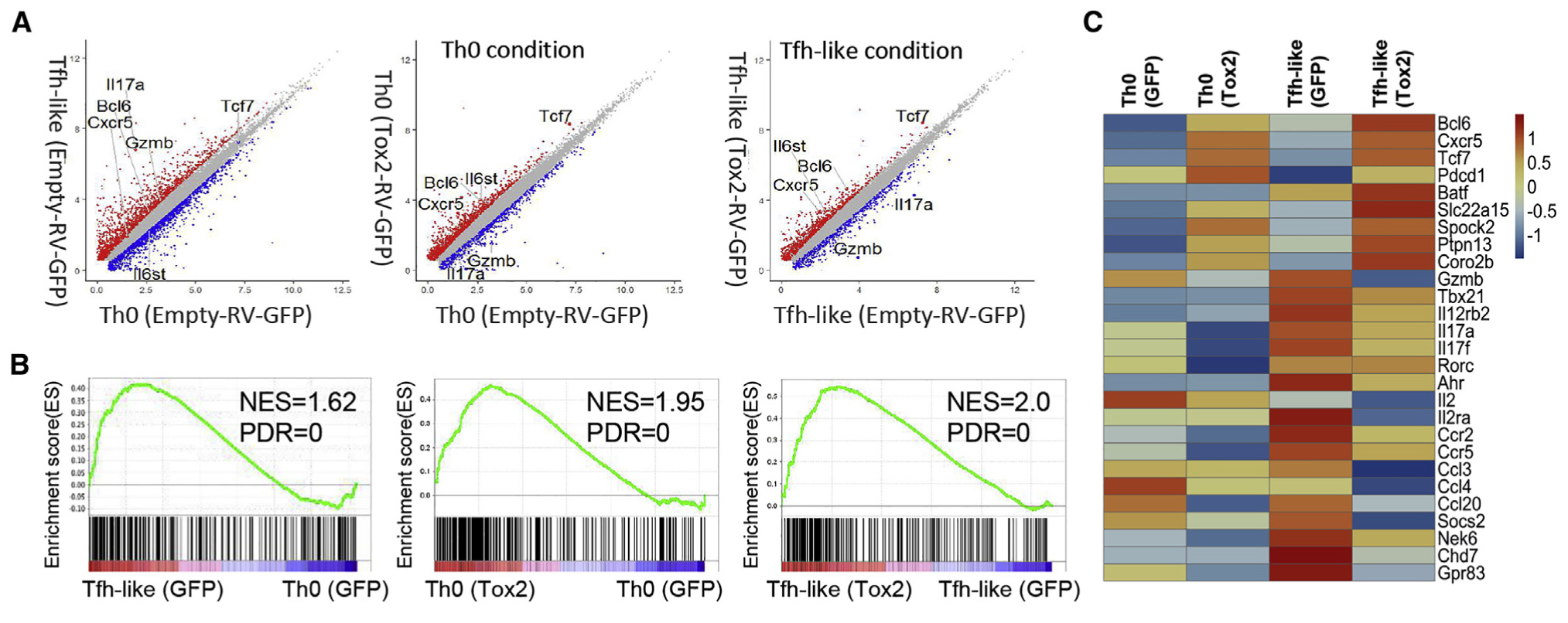
图2. Tfh相关基因的Tox2依赖性转录调控
(A)RNA-seq分析,在感染了Tox2-RV-GFP的Tfh细胞或Tfh和Th0细胞中,上调(红色)或下调(蓝色)的基因分布。
(B)在指示的培养条件下,相对于Th0和Tox2-RV-GFP +与Empty-RV-GFP +细胞中的表达,在Tfh样细胞中上调基因的GSEA。
(C)相对于在Empty-RV-GFP +细胞中的表达,在Tox2-RV-GFP +细胞中上调或下调的相关基因的热图。
为了确定Tox2是否直接调节上面的基因,作者通过ChIP-seq检测了Tox2靶基因,确认了4,628个Tox2结合峰,其中分别有46%、24.6%和35.4%的内含子、启动子和远端基因间区域富集(图3D)。比较显示,在2908个Tox2结合基因中,有336个受Tox2转录调控,包括Bcl6,Cxcr5,Tcf7和Il2ra(图3E)。在Tfh标志基因(Bcl6,Cxcr5,Pdcd1和Batf)和炎性标志基因(Il2ra,Tbx21,Rorc,Il2和Il17a)中发现Tox2结合峰(图3F)。为了确认结果,作者使用表达Tox2:HA的细胞对Bcl6和Cxcr5基因座进行了ChIP-qPCR分析证明了Tox2结合(图3G)。此外,ATAC-seq发现Tox2结合位点与Tfh细胞中的可及区域相关(图3F),从而验证了Tox2在Tfh细胞中的功能。接下来,结合了三个数据集确定了共有59个直接受Tox2调控的基因,将这些基因与Bcl6靶标(74个基因)和Ascl2靶标(44个基因)进行比较发现Tox2、Bcl6和Ascl2仅共同激活了Slc9a9和Tcf7这两个基因,其中TCF-1( Tcf7)被证明是Tfh细胞生成的关键调控因子(图3H)。Tox2和Bcl6可以抑制Th1相关的Ahr、Nek6、Socs2、Ncs1和Chd7基因表达,而Tox2和Ascl2可以抑制Th1相关的Tbx21、Il2ra和Ifitm3基因表达而Cxcr5表达上调(图3H),表明在Tfh发育过程中Tox2与Bcl6和Ascl2协同作用。
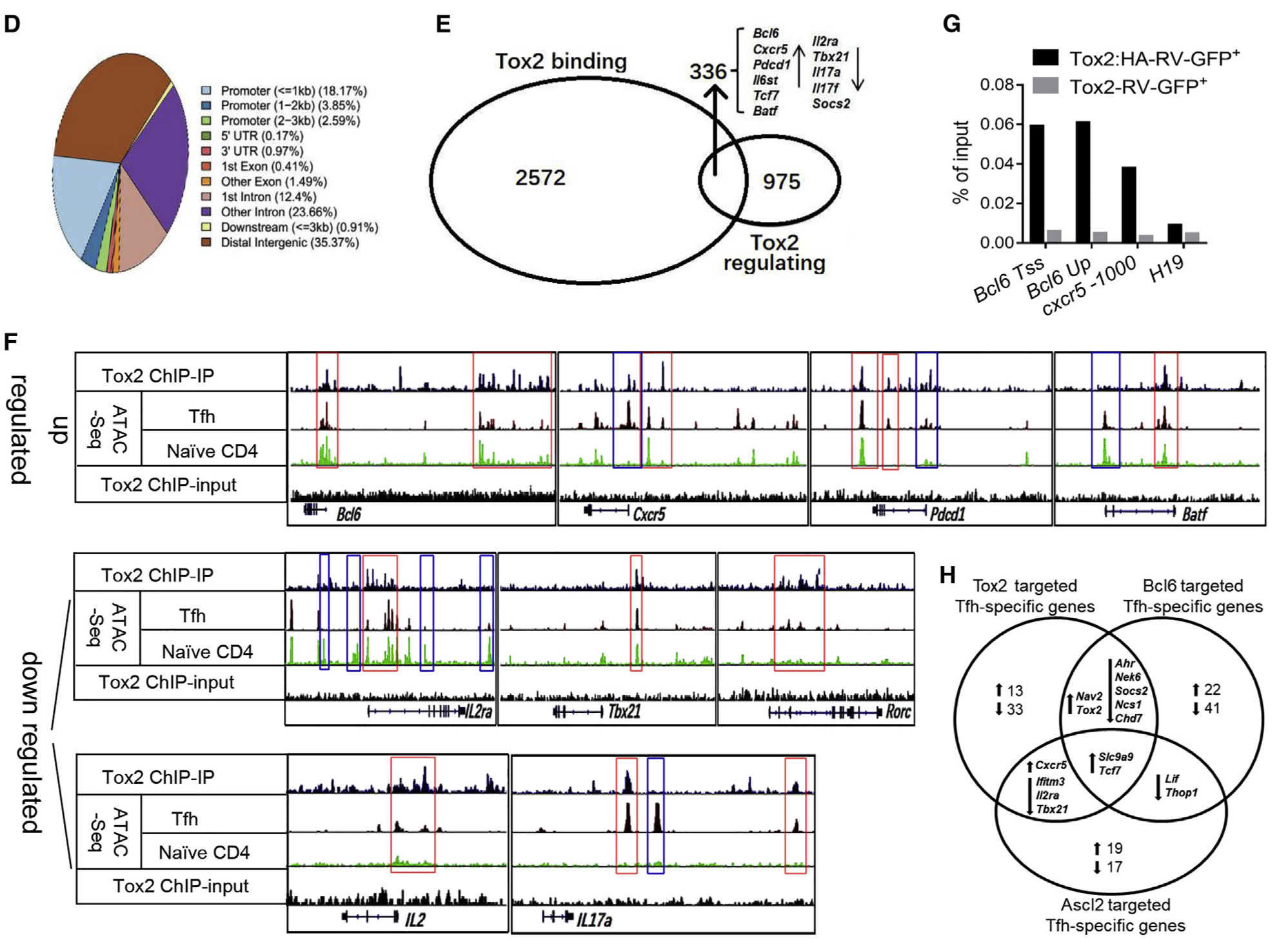
图3. Tfh相关基因的Tox2依赖性转录调控
(D)Tfh细胞中Tox2 ChIP-seq峰的分布。
(E)受Tox2和与Tox2结合的基因调控的基因的维恩图。
(F)Tox2结合峰以及Tfh细胞中可及的染色质区域,位于Bcl6,Cxcr5,Pdcd1,Batf,Il2ra,Tbx21,Rorc,Il2和Il17a等基因位点。
(G)通过ChIP-qPCR确定的在Tfh细胞中Bcl6和Cxcr5基因座的Tox2结合位点。
(H)Tox2-,Bcl6-和Ascl2靶标Tfh特异基因的Venn图。
(3)Tox2功能促进染色质重塑
由于Tox2包含与DNA结合并可能改变染色质构象的高迁移率族(HMG)盒,因此作者假设Tox2编程CD4 + T细胞中的染色质重塑以促进Tfh细胞发育。通过ATAC-seq分析发现在Tfh与原始CD4 + T细胞之间存在超过26,000个区域的差异(图4A)。在Th0条件下或在培养基中激活的被GFP病毒感染的T细胞,只有839个差异区。当Th0添加IL-6来形成类似Tfh的条件时,改变了2071个区域,其中Bcl6,Tcf7,Ror3和Il23r基因座更易获得,而Il7r和Socs2基因座则更少。当Tox2过表达时,在Th0和Tfh条件下可分别8,700和13,000多个区域(图4A)。因此,在Th0和Tfh条件下,阻断IFNg,IL-4和IL-2会降低整体染色质的可及性,而Tox2的表达会增加CD4 + T细胞中可及区域的数量。
数据显示3,546个元素在染色质可及性方面有所提高,包括Bcl6,Cxcr5和Pdcd1位点,在Tox2过表达后Tfh细胞中只有121个基因组位点关闭(图4B和4C),在Th0和Tfh条件下培养的T细胞中,Bcl6,Cxcr5,Pdcd1和Tcf7区域也更容易接近(图4D)。接下来,作者探索Tox2如何影响TF的活性,分析显示,当在激活的T细胞中阻断IFNg,IL-4和IL-2时,Stat1,Stat3,Stat4,Stat5和Stat6结合基序的富集减少(图4E),IL-6信号传导增加了AP-1家族和与Tfh或Th17相关的TF(例如Batf和Stat3)的活性(图4E)。同时,在Th0和类似Tfh的条件下,Tox2过表达后结合力下降,其中Bach2,Prdm1和Stat5负调控Tfh分化(图4E)。这些数据表明Tox2在Tfh分化过程中直接调节染色质的可及性。
图4. Tox2促进染色质可及性
(A)火山图,通过ATAC-seq分析显示了指示细胞中的染色质可及性区域差异。
(B和C)火山图(B)和热图(C)展示了Tox2结合位点处Tfh细胞中Tox2中差异可及区域与对照过表达的区域。
(D)基因组视图,显示了在指定培养条件下Tfh,CM,Empty和Tox2-RV T细胞中的ATAC-seq,以及图3C中Bcl6,Cxcr5,Pdcd1和Tcf7位点的T细胞中的Tox2 ChIP-seq图谱。
(E)在指定子集的不同的染色质可及区域中富集已知的TFs结合基序。
03
Tox2和Tox对于Tfh生成很重要(图略)
为了确定Tox2在Tfh分化中的重要性,作者通过CRISPR / Cas9在保守的外显子3中删除了14个碱基对,产生移码突变和所有同工型的翻译提前终止,证实Tox2缺陷型CD4 + T细胞的内在缺陷会影响Tfh分化。同样的发现Tox2缺陷型OT-II细胞显示出Tfh分子CXCR5,PD-1,Bcl6,Ascl2,Bcl6,Cxcr5和Pdcd1的表达减少,但Il7r mRNA表达增加。考虑到Tox家族除Tox2之外还具有Tox,Tox3和Tox4成员,它们在Tfh细胞分化中是否具有任何冗余功能?首先检测了Tox,Tox3和Tox4的mRNA表达水平,发现Tox2缺陷OT-II中Tox和Tox3(几乎没有表达)表达有所增加但Tox4在这些细胞中的表达下降,这表明Tox在具有Tox2的Tfh细胞中可能具有功能冗余。此外,我们通过检测Tfh细胞Tox mRNA的表达证实了Tox在Tfh细胞中的高表达,这通过流式细胞术实验得到了证实。
为了研究Tox在Tfh发育中的作用,在CD4 + T细胞中进行了Tox过表达,发现Tox在Th0和类似Tfh的培养条件下均能促进Bcl6,Ascl2,Cxcr5,Pdcd1,Il6ra,Il6st,Tcf7和Tox2 mRNA表达,表明Tox也可能促进Tfh的发育。然后,通过将Tox转导的OT-II细胞转移到Tcrbd /受体小鼠中,发现Tox的过表达在第7天显着增加了Tfh细胞的百分比。同时,Tcrbd /小鼠中的GC B细胞也明显增加。在mRNA水平上,Tox转导的OT-II细胞具有更高的Ascl2,Bcl6,Cxcr5和Pdcd1表达。这些数据表明Tox2和Tox都参与促进Tfh发育。
end
