
广州市天河区黄埔大道中124号2705室
电话:020-29031124
手机:18102256923
Email:servers@gzscbio.com
Fax:020-85625352
QQ:2913120624
在基因表达调控的研究中有各式各样的方法,但究竟哪些方法应用到哪些方向中呢?广州赛诚生物科技有限公司根据过往经验,结合当今核心常用技术,做了以下总结。
1 转录调控——蛋白调控DNA的研究方法
1.1 启动子:基因序列中决定转录起始的部位。
1.1.1 转录起始位点(TSS)的确定
(1)生物信息学预测TSS
①预测转录起始位点和启动子区域
②预测CpG岛
(2)5’-RAce初步确定TSS的大概位置
(3)引物延伸、核酸酶保护或S1作图精确定位TSS
1.1.2 启动子区域(顺式作用元件)的确定
(1)生物信息学预测启动子区域
(2)克隆5’-flanking sequence,并连接到报告基因载体中
(3)缺失、突变
(4)荧光素酶活性分析
(5)确定转录调控区域(启动子区域)
1.1.3 转录因子(反式作用元件)结合位点的确定
(1)生物信息学预测转录因子结合位点
(2)实验证实转录因子结合位点:EMSA,ChIP,DNase I足迹分析
1.1.4 反式作用元件和顺式作用元件相互作用对基因转录的影响
(1)定点突变:荧光素酶活性分析
(2)过表达转录因子:测定目的基因的表达
(3)干扰转录因子的表达:测定目的基因的表达
(4)转基因动物
1.2 增强子:基因组中能增强邻近基因启动转录的序列
(1)瞬时转染——Luciferase荧光素酶法
(2)DNAase I hypersensitivity
(3)DNAase I footprinting/mutation analysis
(4)转基因动物
2 转录后调控——蛋白调控RNA的研究方法
(1)RIP,RNA结合蛋白免疫沉淀法
(2)RNA-Protein Pull-Down技术
其中,ChIP、RIP、RNA pull-down、EMSA、Luciferase、生物信息学等为其中的核心技术,也是未来的主要研究方法趋势。接下来,广州赛诚生物科技有限公司针对这些核心技术作进一步介绍。
1 免疫沉淀法(chromatin immunoprecipitation analysis,ChIP)
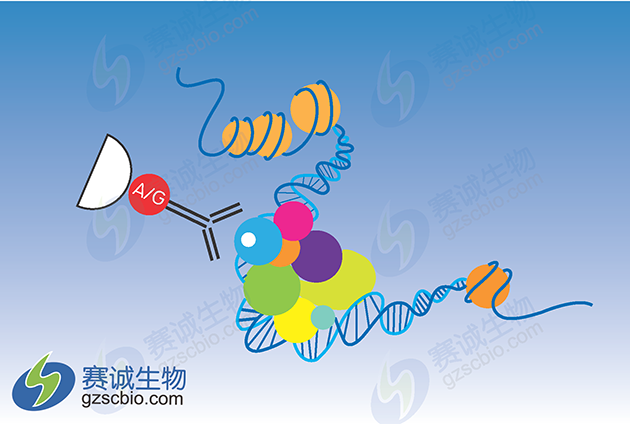
图1 ChIP原理示意
染色质免疫沉淀技术(Chromatin Immunoprecipitation ,简称ChIP) 是一种在体内研究DNA和蛋白质相互作用的方法。它的发明最早可以追溯到20世纪60年代,早期曾多用于研究核小体上的DNA和组蛋白的相互作用以及组蛋白的修饰。近年来,此技术经过不断的发展和完善,特别是与DNA 芯片和分子克隆技术相结合,可用于高通量的筛选已知蛋白因子的未知DNA 靶点和研究反式作用因子在整个基因组上的分布情况。该技术在国外已经得到了广泛的应用,但在国内还鲜有报道,特别是在使用染色质免疫沉淀技术高通量的筛选已知蛋白因子的未知DNA 靶点方面,尚属空白。
简而言之,染色质免疫沉淀技术的原理是:在生理状态下把细胞内的DNA 与蛋白质交联在一起,超声波将染色质打碎后,用所要研究的目的蛋白特异性的抗体沉淀这种交联复合体。只有与目的蛋白结合的DNA 片段才能够被沉淀下来,后解除偶联、纯化目的片段并检测等步骤来获得蛋白质与DNA相互作用的信息。
ChIP能捕捉到发生在染色质水平上的基因表达调控的瞬时事件,如实、完整地反映DNA与蛋白质的动态结合旧,但该方法尚存些不足,如:难以同时得到多个因子对同一序列结合的信息,或目标蛋白不是直接地与染色质结合等。研究者不断地发展和完善此技术,建立了广泛用于特定反式因子靶基因的高通量筛选的CHIP—chip(芯片)方法。该技术能够快速在目标基因组的染色体中确定特异DNA结合蛋白的准确结合位点, ChIP芯片也可以在一个基因组的任何感兴趣的区域内寻找染色体的结构改变。 ChIP-Chip被应用于:
(1)在基因组范围内确定基因转录因子的DNA结合位点和其他DNA结合蛋白或蛋白复合体的DNA结合位点。
(2)染色体活性状态的定量分析。
(3)组蛋白修饰的功能研究。通过用酰基化或甲基化的组蛋白的特异抗体和没有进行修饰的组蛋白的特异抗体,可以确定与组蛋白修饰有关的结合模式的变化。
(4)聚合酶活性的定量分析。
(5)精炼生物信息方法,用功能数据来确定启动子的位置。
2 RNA结合蛋白免疫沉淀法(RNA-Binding Protein Immunoprecipitation,RIP)
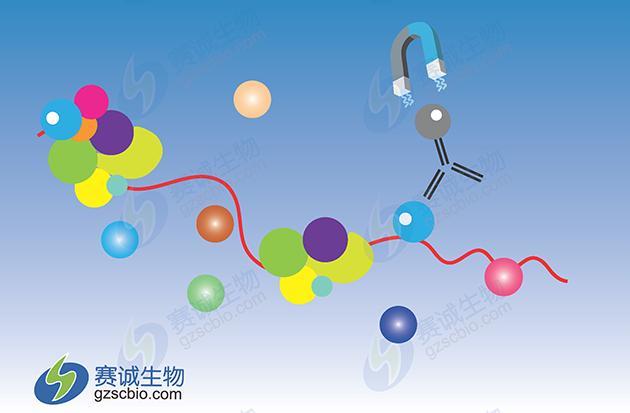
图2 RIP原理示意
RNA是一种不稳定的生物大分子, 绝大多数的 RNA都需要与特定的RNA结合蛋白质结合形成RNA/蛋白复合物才能稳定存在于细胞中; 不仅如此, RNA 与 RNA 结合蛋白之间的动态关联贯穿和伴随了 RNA 的转录合成、加工和修饰、胞内运输和定位、功能发挥及降解的整个生命循环。鉴于此, 利用 RNA 结合蛋白分离或发现鉴定功能性 RNA 分子是 RNA研究领域中一个不可或缺的研究方法。
RIP技术(RNA Binding Protein Immunoprecipitation,RNA结合蛋白免疫沉淀),是研究细胞内RNA与蛋白结合情况的技术。运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析;即用抗体或表位标记物捕获细胞核内或细胞质中内源性的RNA结合蛋白,防止非特异性的RNA的结合,免疫沉淀把RNA结合蛋白及其结合的RNA一起分离出来,结合的RNA序列通过microarray(RIP-Chip),定量RT-PCR或 高通量测序(RIP-Seq)方法来鉴定。是了解转录后调控网络动态过程的有力工具,能帮助我们发现miRNA的调节靶点。
简单地说, 就是利用 RNA结合蛋白的抗体免疫沉淀 RNA/蛋白复合物, 再从沉淀的 RNA/蛋白复合物中分离得到特定 RNA结合蛋白的 RNA; 分离得到的 RNA可以通过末端标记和变性胶电泳对 RNA 分子的大小进行鉴定, 也可以利用高通量 RNA 测序方法对 RNA 序列进行分析。
3 RNA-Protein Pull-Down技术
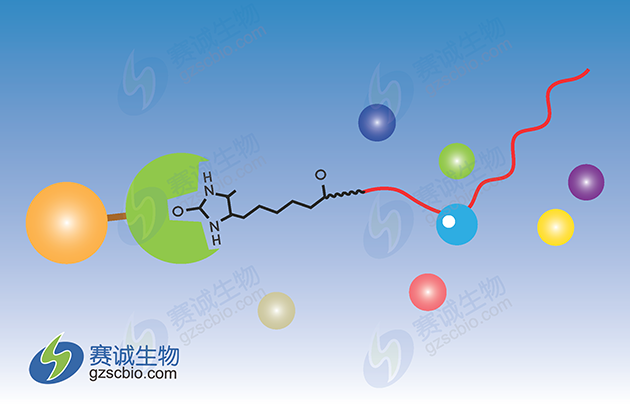
图3 RNA pull-down原理示意
蛋白质与RNA的相互作用是许多细胞功能的核心,如蛋白质合成、mRNA组装、病毒复制、细胞发育调控等。了解它们之间相互作用的分子机制对理解这些生物学过程非常重要。然而,之前的分析方法往往受限于使用放射性标记,或实验步骤过多,不仅耗时费力,也增加了实验结果的不稳定。以末端标记的RNA作为诱饵,轻松富集蛋白质-RNA的相互作用。
RNA-Protein Pull-Down技术基本原理:使用体外转录法标记生物素RNA探针,然后与胞浆蛋白提取液孵育,形成RNA-蛋白质复合物。该复合物可与链霉亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。复合物洗脱后,通过western blot实验检测特定的RNA结合蛋白是否与RNA相互作用。或将复合物洗脱后所得未知混合蛋白质谱检测。
4 电泳迁移率变动分析(electrophoresis mobility shift assay,EMSA )
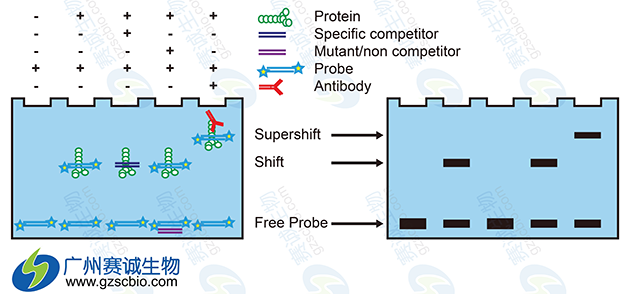
图4 EMSA原理示意
电流迁移率变动分析又称凝胶阻滞实验(electrophoresis mobility shift assay).是一种简单、快速和极为灵敏的体外检测DNA与蛋白质相互作用的技术,它可实现对目的蛋白的定性和定量分析,此外,也可以用于构象变化的分析。
在EMSA实验中,纯化的DNA特异结合蛋白或细胞粗提液和经标记的DNA或RNA探针一同温育,在非变性的聚丙烯酰胺凝胶电泳上分离蛋白质——DNA复合物和游离的探针。这是因为蛋白质——DNA复合物的迁移率主要取决于蛋白质的大小、形状、电荷和对称状态,它的迁移速度要比游离的DNA慢得多,从而在凝胶上形成滞后带。我们根据所显示滞后带的有无和量的多少,来反映DNA结合蛋白与DNA探针的结合活性、 DNA结合蛋白的表达水平,并可以计算出两者的结合常数或解离常数。
凝胶迁移实验需要的结合蛋白,可来源于纯化或部分纯化的蛋白,或粗的核和胞质抽提液。还必须制备同位素标记的DNA或RNA。结合反应所需的组分有:含盐的溶液(氯化镁,氯化钠,或氯化钾)、缓冲体系( Tris-HCl或HEPES)、还原剂( DTT)、甘油、非特异的竞争DNA( poly(dI:dC)(dI:dC)),也可能含非离子去污剂。
EMSA结合反应一般都要设置如下结合反应: 1 ,阴性对照反应(标记探针); 2,常规反应(含激活的目的转录因子的核蛋白+标记探针); 3,探针冷竞争反应(含激活的目的转录因子的核蛋白+标记探针+标记探针100倍量的未标记探针); 4,突变探针的冷竞争反应(含激活的目的转录因子的核蛋白+标记探针+标记探针100倍量的未标记突变探针); 5, Super-shift反应(含激活的目的转录因子的核蛋白+标记探针+目的转录因子的特异抗体)。
传统的EMSA分析通常采用放射性同位素(如32p 3H)标记的寡核苷酸探针,该方法虽灵敏性高、特异性强,但因同位素的半衰期短,且易于污染环境、危害身体等因素,在一般的实验室无法进行,其应用的广泛性受到了极大的限制。目前,人们已采用了地高辛和生物素标记的寡核苷酸来代替传统的放射性同位素标记的寡核苷酸,并在EMSA试验中获得成功。同时基于EMSA的基础上发展了超迁移率变动分析 (supershift assay)和毛细管凝胶阻滞电泳,前者特异性要比EMSA好,常用于鉴定其他方法筛选出来的结果;后者样品用量少、分辨率高,可用于一些受限制比较大的DNA——蛋白质互作分析,如胚胎发育的研究过程。
5 Luciferase实验
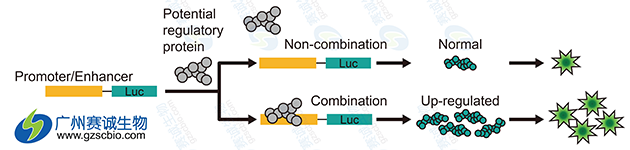
图5 Luciferase研究增强子原理示意
Luciferase报告基因系统是以荧光素(luciferin)为底物来检测萤火虫荧光素酶(fireflyluciferase)活性的一种报告系统。荧光素酶可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物荧光(bioluminescence)。然后可以通过荧光测定仪也称化学发光仪(luminometer)或液闪测定仪测定luciferin氧化过程中释放的生物荧光。荧光素和荧光素酶这一生物发光体系,可以极其灵敏、高效地检测基因的表达。是检测转录因子与目的基因启动子区DNA相互作用的一种检测方法。
6 生物信息学方法及生物芯片技术
生物信息学是在生命科学的研究中,以计算机为工具对生物信息进行储存、检索和分析的科学。它包含着生物信息的获取、处理、存储、分配、分析和解释的所有方面。具体地说,生物信息学是用数理和信息科学的观点、理论和方法去研究生命现象,组织和分析呈现指数增长的生物学数据的一门学科。 Luscombe和Thornton利用氨基酸序列的保守性构建计算机算法来预测蛋白质/DNA复合体中DNA 的结合位点。 Selvaraj等将蛋白质/ 核酸复合体中原子电荷势能作为训练数据集,利用人工智能技术来预测蛋白质对DNA的识别位点。 Ahmad等将蛋白质的序列组成、可溶解性以及二级结构等信息数据用人工神经网络算法进行训练,构建了在线蛋白质/ 核酸结合预测技术,预测成功率达到了69%。此后Ahmad 和Sarai将此技术进一步加强,在训练人工神经网络时加入了蛋白质进化关系的信息,使预测成功率提高了8.7%。目前建立在 蛋 白 质 / 核 酸 相 互 作 用 基 础 上 的 较 重 要 的 数 据 库 为 蛋 白 质 , 核酸识别数据库,利用该数据库能帮助研究者了解核酸被蛋白质识别的机制。
7 DNase I 足迹法(DNase I footprinting)
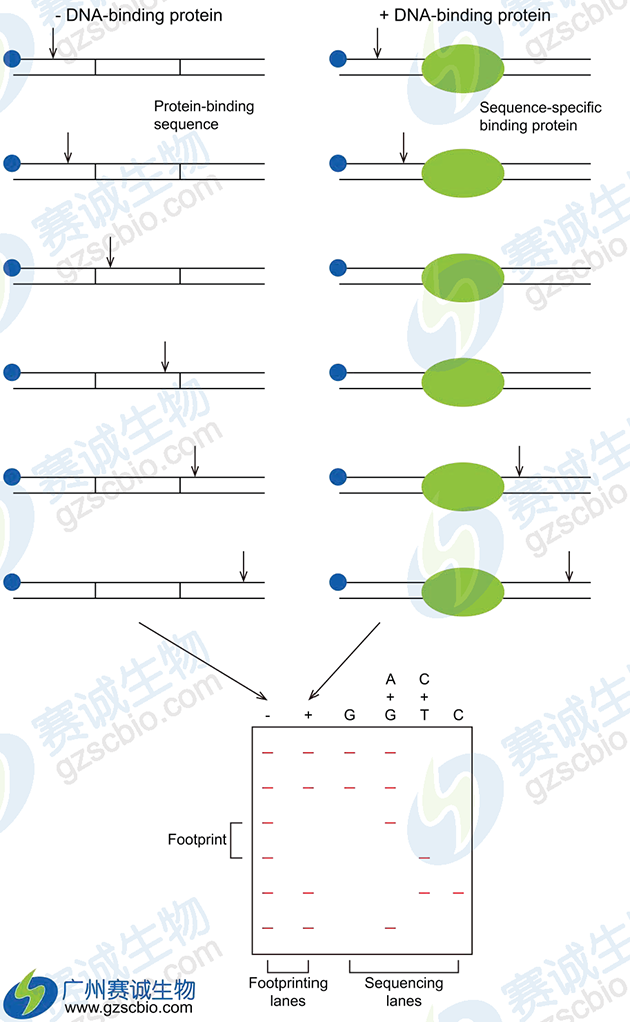
图6 DNase I 足迹分析
足迹试验的方法较多,常用的有DNase I足迹试验、硫酸二甲酯足迹试验(dimethylsulfate, DMS),二者原理基本相同,DNase I足迹法于1978年引入科研领域,其原理与DNA的化学测序法相似,首先将待测双链DNA片段中一条链的一端选择性地进行标记,然后加入恰当浓度的DNaseI, 使在DNA链上形成缺口,经过变性后电泳分离,放射自显影,即形成以相差一个核苷酸为梯度的DNA条带。但当DNA片段与相应的序列特异性DNA结合蛋白结合后, DNA结合蛋白可保护相应的DNA序列不受DNase I 的攻击,因此在放射自显影图谱上, DNA梯度条带在相应的DNA结合蛋白的结合区域中断,从而形成一空白区域,恰似蛋白质在DNA上留下的足迹,因而被形象地称作足迹法。如果同时进行DNA化学测序,即可判断出结合序列的精确顺序,该技术至今仍然是最常用的方法,但是在实际应用中,首先应将序列特异蛋白进行一定程度的纯化,如硫酸铵分步沉淀,离子交换层析,凝胶过滤层析等,否则很难得到满意的结果。因此在该足迹法的基础上又发展了固相DNaseI足迹法,它具有如下优点: (1)采用生物素进行末端标记,避免放射性同位素的掺人,减少危害; (2)省略了有机抽提、沉淀等蛋白纯化步骤,操作简便,效率高; (3)使用范围广,可适用于未经纯化的核蛋白粗提物内特异性DNA结合蛋白的研究。
常与EMSA法结合共同用于体外DNA——蛋白质相互作用的鉴定,但二者的侧重点不同. EMSA主要用于与特异性DNA结合的目标蛋白的检测,而DNase I足迹法在此基础上进一步证明了DNA元件和目标蛋白的特异结合,并能告知与该蛋白结合的相应DNA元件序列。
8 5’RLM-RACE技术
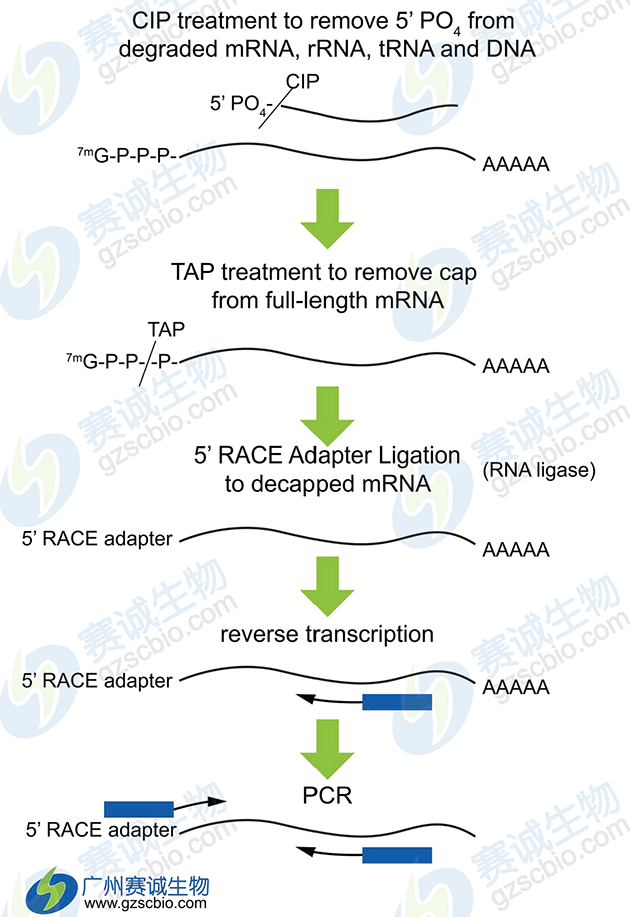
图7 5’RLM-RACE技术
该技术主要用于确定TSS的大概位置。
9 酵母单杂交技术(yeast one hybrid system)
该技术是由Li JJ和Herskowitz I从酵母双杂交技术发展来的。体外分析DNA与细胞内蛋白质相互作用的一种方法,通过对酵母细胞内报告基因表达状况的分析,来鉴别DNA结合位点并发现潜在的结合蛋白基因,或对DNA结合位点进行分析。运用此技术,能筛选到与DNA 结合的蛋白质,并可直接从基因文库中得到编码该蛋白质的核苷酸序列,而无需复杂的蛋白质分离纯化操作,故在蛋白研究中,具有一定的优势;而且,酵母属真核细胞,通过酵母系统得到的结果比其他体外技术获得的结果更能体现真核细胞内基因表达调控的真实情况。
酵母单杂交系统已被用于克隆多种重要的DNA结合蛋白,该系统相对直接、快捷、灵敏,筛选到的蛋白是在体内相对天然条件下有结合功能的蛋白质,比其他体外技术获得的结果更能体现真核内基因表达调控的真实情况,且无需复杂的蛋白质分离纯化操作。但因细胞技术的先天局限性和所用报告基因His3或 lacZ的自泄漏表达等缺陷。在实际操作中常出现漏检和假阳性现象。
10 SELEX与核酸适体技术
用 于 DNA- 蛋 白 质 相 互 作 用 研 究 的 指 数 富 集 配 体 系 统 进 化 (systematic evolution of ligands by exponential enrichment, SELEX)技术诞生于上世纪90年代初,目前已经成为在数量众多的靶分子中,高亲和性和特异性地确定适配了的一种崭新的方法。 SELEX的流程即是人上合成随机寡核苷酸序列、适配子筛选、扩增、再循环的过程。在这一过程中,适配子修饰基团文库的应用,使得SELEX流程更加经济,快捷,高通量。
SELEX是一种新型的体外筛选技术,它以DNA与蛋白质相互作用为基础建立随机寡核苷酸文库,从中筛选到能与各种配体(靶蛋白)特异性结合的单链寡聚核苷酸片段,长度一般为20~40bp,该寡核苷酸片段就称为核酸适体(aptamer)。
SELEX技术的基本原理:首先人工合成一个含有1013~1015个单链寡核苷酸序列的随机文库,序列长度往往在25~35之间。而单链的随机寡核苷酸序列,尤其是RNA,容易形成可与蛋白质、核酸等靶物质特异性共价结合的二级结构,如发卡(hairpin)、茎环(stem-loop))、 G-四聚体(G-tetramer)等等。在这一高亲和力特异性结合的基础之上,靶物质如氨基酸、多肽、甚至金属离子都可以同随机文库(池)相互作用,选择性分离出适配子,然后通过PCR等建立在转录基础上的技术,生成次一级文库,再与靶物质结合,反复多次循环,即可获得与靶物质特异性高亲和力结合的适配于。
在这一过程中,随机序列寡核苷酸文库在一个给定温度的选择性缓冲液池中,可以同靶物质亲和作用的特异性序列非常少,只有通过物理分离技术加以纯化。大分子如蛋白质可以通过硝酸纤维膜过滤;小分子如核酸、多肽等,可以通过简单的修饰,添加上可以与固相支持物产生亲和作用的基团,经简单的冲洗即可以达到纯化目的。高亲和性适配子的富集效率,取决于多重循环中每一次循环的严紧性,经过多次的选样性分离扩增后,达到了饱和状态,富集的文库被克隆,相应的序列信息也被获得。
适配子纯化循环的次数取决于每一次循环的严紧程度。一般而言,对于大多数靶物质在8~1 5次循环中刚可得到亲和富集, 2天内可完成一次SELEX循环,包括克隆和测序。一个典型的SELEX过程可能持续2~3个月。一旦序列确定,适配子可由化学合成来生产,少量适配子的纯化和分析不超过3天,可以产生足够数量(几个摩尔)的适配子用于后继的开发和研究。最近SELEX过程实现了自动化,将人为因素的干扰减少到最低。在微型自动化分析仪上可同时执行多个独立的重复SELEX过程,使适配子的发现更加快捷、经济和高通量。
据此,其筛选过程可简单归纳为: (1)体外合成含1013~1015个单链寡核苷酸序列的随机文库; (2)在适宜条件下,孵育单链寡核苷酸库与靶蛋白形成DNA-蛋白质复合物; (3)分离未与靶蛋白结合的寡核苷酸; (4)解离与靶蛋白结合的寡核苷酸,以此为模板进行PCR扩增,得到特异结合的寡核苷酸库,再进行下轮的筛选过程; (5)通过反复筛选与扩增,得到亲合力强于抗原抗体之间的高特异核酸适体。
核酸适体技术已成为适配体筛选的有效工具,其所结合的靶分子范围非常广泛,除蛋白质之外,还可以是酶、核酸、细胞黏附分子、植物凝集素、病原菌、有机物甚至是金属离子等,且筛选到的适配体能识别单抗不能区分的蛋白质。基于这些特性,核酸适体技术已在基础研究、临床诊断、药物筛选、生物传感器等领域应用。但需注意的是, SEIZX技术是体外实验,其筛选到的核酸适体所表现出的一些优良性质,在体内实验中可能会完全失效;核酸适体与靶分子的非特异性结合及适配体的同源性、亲和力等的影响,造成了SELEX的前期筛选工作的复杂性。这也是SELEX技术亟待解决的两个问题。如果完成适配体的各种有效修饰及安全的药物评价模型的构建, SELEX技术存在的问题也将逐步解决。
11 荧光技术
该技术已广泛用于生物分子之间的相互作用研究。由于核酸及其链上的碱基的荧光产率很低,蛋白质组成里也只有色氨酸、酪氨酸和苯丙氨酸有天然荧光,所以采用“内源荧光”的分析方法受到了很大的限制。用于研究DNA-蛋白质相互作用的荧光法,主要是将荧光物质修饰到蛋白质或核酸分子上构成新型荧光标记物质并结合相关仪器而改造成新型的检测技术。它对待测物质的浓度要求低,灵敏度高且部分荧光技术可实现对待测物质的动态分析等,基于这些优点,在短短的几年内得到了迅速发展。
激光诱导荧光(Laser Induced Fluorescence. LIF)技术是常用的荧光技术之一,其灵敏度非常高,浓度检出可达到10。13mol/ L,对于某些荧光效率高的物质甚至可达单分子探测水平,且检测时间短、样品需要量少、可在线检测等优点。目前, LIF常与毛细管电泳(capillary electrophoresis, CE)连用形成毛细管电泳联合激光诱导荧光技术CE-LIF,该技术成为生物、化学、医学等高灵敏检测领域的首选技术之一。
12 扫描探针显微技术
扫描探针显微镜(Scanning probe microscope. SPM)是扫描隧道显微镜(scanning tunneling microscope, STM)、原子力显微镜(atomic force microscope, AFM)、扫描近场光学显微镜(scanning near-field optical microscope, SNOM)、弹道电子发射显微镜(ballistic electron emission microscope, BEEM)、扫描力显微镜(scanning force microscope, SFM)
等一系列仪器的总称,是上世纪被国际科学界公认为80年代世界十大科技成就之一。它利用探针尖端与样品分子间的相互作用对生物分子进行成像,并以原子或分子分辨率探测生理环境下的生物表面力,所以通过该技术可观察单个原子层的局部表面结构,得到直观的表面三维图像和相关的表面结构的信息,亦可以在生理条件下连续观察生物样品,了解某些生命活动的动态过程。其中,原子力显微镜(AFM)在研究DNA-蛋白质的相互作用方面有着较广泛的应用,它能对每一个DNA、蛋白分子以及DNA-蛋白质复合体分别观察并进行定性和定量分析,提供更多真实直观的信息。
SPM作为一种崭新的技术手段,在研究DNA-蛋白质相互作用的领域起到越来越重要的作用,但尚存在一些不足,如SPM扫描速度过低,满足不了细胞内的分子反应速度;体外实验能否真实反应细胞内的生化反应过程,固定表面的存在对DNA-蛋白质反应会产生哪些影响等问题尚未清楚。
13 生物质谱技术和表面等离子共振技术
生物质谱技术采用先进的软电离技术使过去主要用于小分子研究的质谱技术发生了重大变革,它主要包括电喷雾质谱(electrospray ionization mass spectrometry, ESI—MS)、基质辅助激光解吸/电离质谱(matrix assisted laser desorption/ ionization mass spectrometry, MAIDI—MS)、快原子轰击质谱(fast atom bombardment mass spectrometry, FAB—MS)和同位素质谱(istope mass spectrometry)等,这些技术准确度、灵敏度和自动化程度高,对于研究结合位点十分有效,已成功地应用于核酸、蛋白质和多肽等生物大分子的分析。
表面等离子共振(surface plasma resonance, SPR)是近年来新技术研究的热点之一,它利用入射光以临界角入射到两种不同折射率的介质界面(比如玻璃表面的金或银镀层)时所引起金属自由电子的共振而使反射光在一定角度内大大减弱甚至完全消失的物理现象,来获取生物反应过程中样品的折射率与共振角(即反射光完全消失时的入射光角度,又称SPR角)的动态变化,进而得到生物分子之间相互作用的特异性信号。 SPR技术可以原位、实时和动态地反映蛋白质-蛋白质、蛋白质-核酸、新药分子-疾病靶蛋白等生物分子间的互作信息,是分子间互作研究的有力手段,已广泛地用于研究生物分子间的识别和特异性作用。
