
广州市天河区黄埔大道中124号2705室
电话:020-29031124
手机:18102256923
Email:servers@gzscbio.com
Fax:020-85625352
QQ:2913120624
在基因表达调控的研究中,miRNA与lncRNA是十分重要的一个环节。它们介导了转录调控、转录后调控,甚至是翻译调控几个重要的基因表达模块。与此同时,miRNA与lncRNA两者又有着十分微妙的相互作用关系。
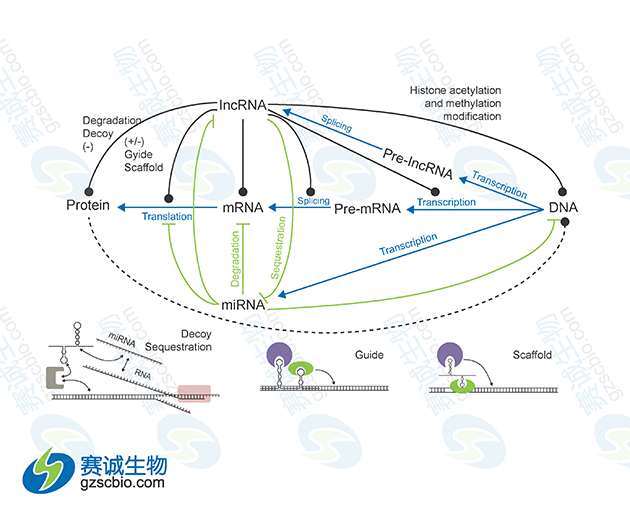
图1 miRNA与lncRNA在基因表达调控中的相互关系
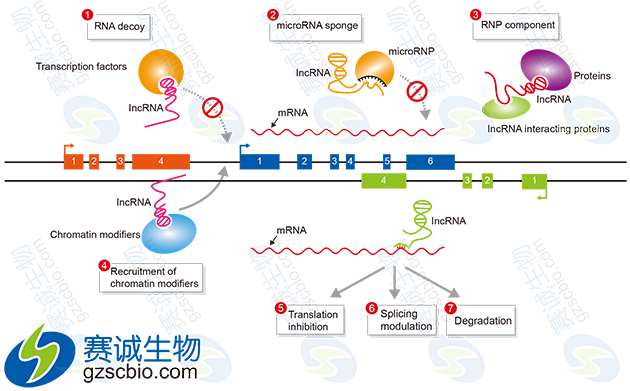
图2 miRNA与lncRNA在基因表达调控中的作用机制
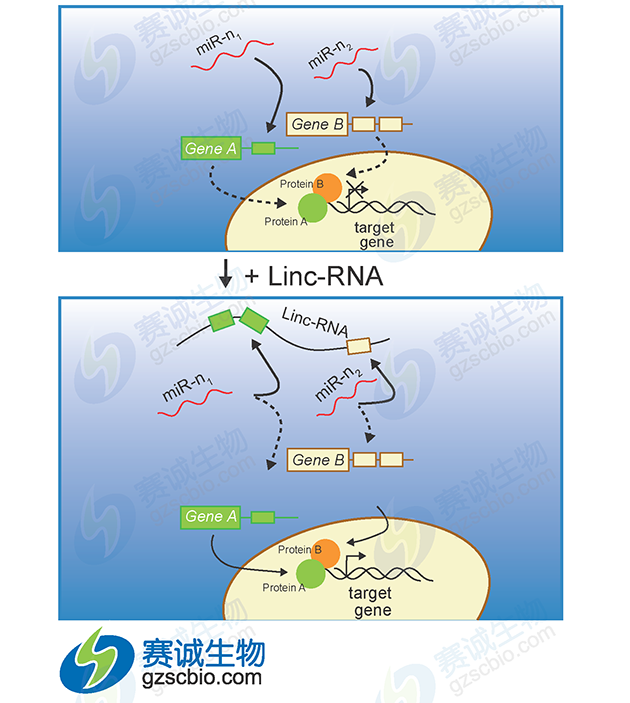
图3 miRNA调控lncRNA
LncRNA可以通过直接与靶基因结合来激活或抑制靶基因的表达,还能通过参与组蛋白修饰或募集转录因子而参与基因的表达调控,也可以作为一种竞争性内源性 RNA 与miRNA相互作用,参与靶基因的表达调控。LncRNA可作为ceRNA与miRNA之间互相调控。
由于多数LncRNA的结构与mRNA 具有一定的相似性,提示 miRNA可能通过类似于mRNA 的作用机制负性调控LncRNA的表达,进而发挥一系列生物学作用。同时,miRNA也能促进特异LncRNA的表达。
MicroRNA(miRNA)是一类长度为 20-25nt,从发夹结构前体加工而来的具有基因调控功能的小分子非编码 RNA,能与受其调控的靶 mRNA 的 3’非编码区(3’UTR)互补结合,通过降解靶基因 mRNA 或抑制 mRNA 的翻译在真核基因表达的转录后调控过程中发挥重要作用,并广泛参与细胞增殖、分化、凋亡及细胞周期调控等过程。研究证明,miRNA参与各种各样的调节途径,包括发育、病毒防御、造血过程、器官形成、细胞增殖和凋亡、脂肪代谢等等。miRNA 与细胞的癌变及多种肿瘤的发生有着极为密切的关系,其可作为一种新的癌基因或抑癌基因参与癌症的发生、发展、侵袭和转移。miRNA基因通常是在核内由RNA聚合酶II(polI)转录的,最初产物为大的具有帽子结构(7MGpppG)和多聚腺苷酸尾巴(AAAAA)的pri-miRNA。成熟的 miRNA 是由较长的有发夹结构的前体转录产物经Dicer 酶加工而来的。miRNA 基因存在于基因组的基因间隔区、外显子区或者基因的内含子当中。
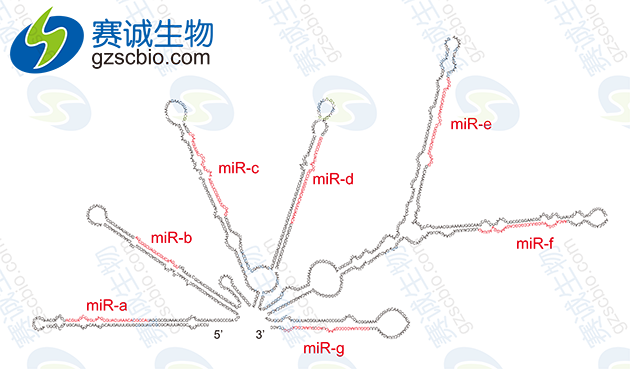
图4 miRNA前体结构
1 miRNA特点
1) 广泛存在于真核生物中, 是一组不编码蛋白质的内源性单链短序列小分子RNA , 它本身不具有开放阅读框架(ORF) 。 通常的长度为18~25 nt , 但在3′端可以有1~2 个碱基的长度变化。
2) 成熟的miRNA 5′端有一磷酸基团, 3′端为羟基, 两者可以和上游或下游的序列不完全配对形成茎环结构。 这一特点使它与大多数寡核苷酸和功能RNA 的降解片段区别开来。
3)多数miRNA具有高度保守性、时序性和组织特异性。miRNA 不仅在结构上保守,而且在物种间具有高度的进化保守性。细胞特异性和组织特异性是 miRNA 表达的主要特点。
4)miRNA 基因以单拷贝、多拷贝或基因簇等多种形式存在于基因组中(图1),而且绝大部分位于基因间隔区(intergenicregion,IGR)。
2 miRNA的生物发生
目前,动物 miRNA 的生物合成、加工、运输和作用原理已经初步阐明。
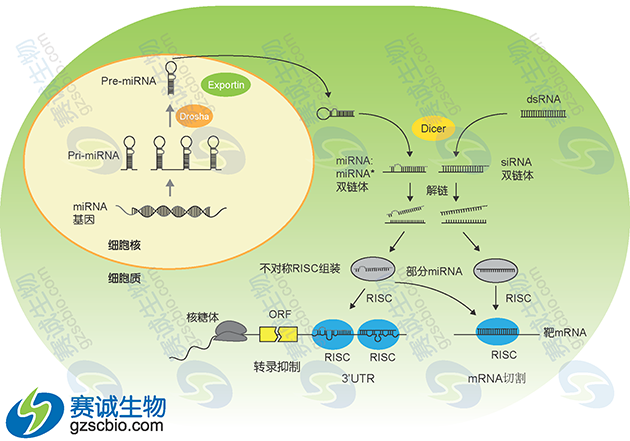
图5 miRNA产生过程模式
首先,在 RNA 聚合酶作用下细胞核中编码 miRNA 的基因转录生成长度约为几千个碱基的初级转录本 pri-miRNA,Pri-miRNA 在 5’端具有甲基化的鸟嘌呤,而 3’端具有多聚腺嘌呤碱基,同时具有一个或几个局部的发夹状结构,以多顺反子形式存在。并且,α-amanitin 可以抑制这一转录过程。有一部分 miRNA 的转录是由 RNA 聚合酶 II 所完成的。Pri-miRNA 的进一步加工主要在 microprocessor 的蛋白复合体完成(图2)。这个大小约为 400-500 kDa 大小的复合体主要由 Drosha 和 Pasha 两个蛋白组成。其中 Drosha 为一种 RNase III 蛋白,而 Pasha 则是一个双链RNA 结合蛋白(double-stranded RNA binding protein),参与 Drosha 对底物的识别。Pri-miRNA 在 Drosha 的作用下进一步被加工成含有 60~70nt 具有茎环结构的 miRNA 前体(pre-miRNA)。 pre-miRNA 在 RanGTP/Exportin-5 转运蛋白的协助下从核内转运到细胞质中。在细胞质中,pre-miRNA 被 Dicer 识别,并通过对茎环结构的剪切和修饰,在细胞质内形成 miRNA:miRNA*二聚体。 miRNA:miRNA*二聚体在解旋酶作用下,最终生成成熟的、具有功能单链 miRNA,并随之和 miRNP(miRNA ribonucleoproteins)复合体结合,而miRNA*则被迅速降解。
3 miRNA作用机制
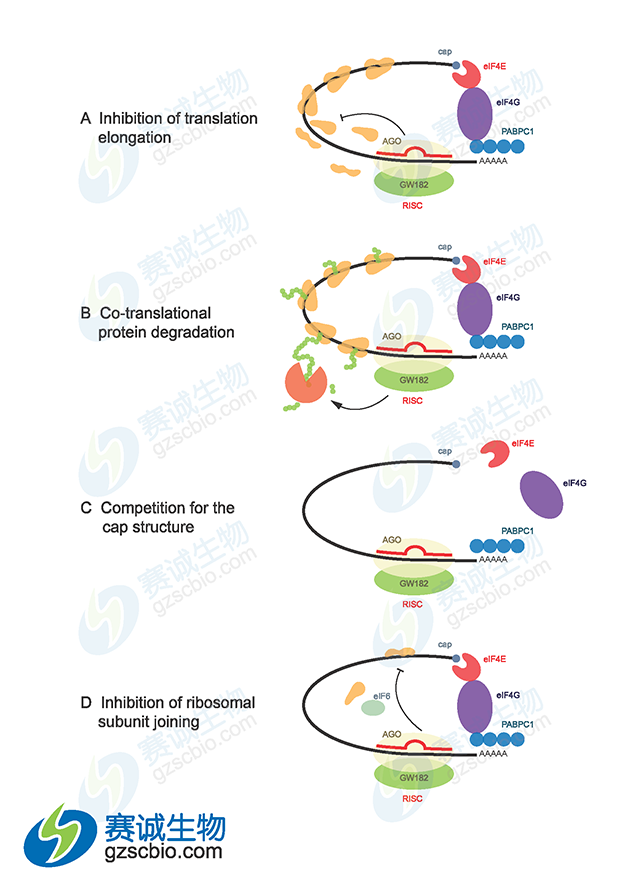
图6 miRNA介导基因沉默机制
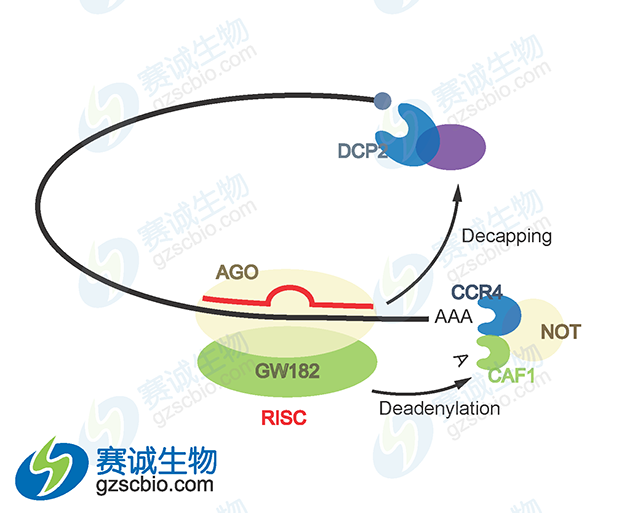
图7 miRNA接到信使RNA降解
miRNA 在发挥作用之前,需要同细胞内 Germin3、Germin4 和 Argonaute蛋白家族成员 eIF2C2 因子等协同因子结合形成蛋白质-RNA 复合物(miRNA-containing ribonucleoprotin,miRNP),在 miRNP 的作用下指导其识别同源 mRNA,研究认为 miRNP 即为 RISC,并引起靶 mRNA 的降解或翻译的抑制。 miRNA 对靶基因的调控表现在转录后水平上,通过对靶基因 mRNA 的切割或对其翻译抑制两种机制来下调靶基因的表达。这两种机制的选择主要取决于它与靶基因 mRNA 序列互补的程度,如果 miRNA 与靶基因 mRNA完全互补,miRNA 将通过切割方式来调控靶基因;如果 miRNA 与靶基因mRNA 不完全互补, miRNA 将通过翻译抑制的方式来调控靶基因;并且对靶基因翻译的抑制可能需要多种 miRNA 分子的协同作用 。在动物体内,大部分 miRNA 不能与靶基因的 mRNA 完全互补,故被认为主要通过翻译抑制的方式来调控靶基因。
(1)在大多数情况下包括人类,大多数动物复合物中的成熟 miRNA与靶基因 mRNA3’端非翻译区(untranslatedregion,UTR)不完全互补配对,在转录后水平抑制靶基因的表达,抑制该基因的翻译过程,从而抑制基因的表达。
miRNA 以 4种不同的方式抑制蛋白质表达:①与翻译偶联的蛋白质降解;②翻译延长的抑制;③翻译提前终止(核糖体脱落);④翻译起始的抑制。另外,尽管有不完全的 mRNA—miRNA 碱基配对,动物 miRNA 能够诱导mRNA 靶基因大量降解。微 RNA 还可以在称为 mRNA 加工体或 P 体(不存在翻译机制)的独立细胞质位点,通过螯合 mRNA 使其沉默。miRNA 是否进行 mRNA 降解主要取决于 miRNA 结合位点和 RNA 环境的特定性质,最可能的决定因素是 miRNA 与特定标靶结合蛋白的特殊相互作用。miRNA 可以与 Ago2 结合,将与它们结合的靶基因 mRNA 转移到并富集于细胞质的某一部位,在那里 mRNA 被破坏,这个部位被称为 P 小体,P体的其他组分,如 GW182、CAF-CCR4-NOT 脱腺苷酶复合物、脱帽酶 DCP2、脱帽激活因子(如 DCP-1、EDC3、Ge-1)和 RNA 解旋酶 RCK/p54 等都参与 miRNA 功能。
(2)当 miRNA 与 mRNA 完全互补配对时,则引起目的基因 mRNA 在互补区的特异性断裂,从而导致基因沉默,这种 miRNA 对靶基因 mRNA 的切割对靶基因 mRNA 的切割是大多数植物、病毒和部分动物的 miRNA 调控靶基因的主要方式。miRNA 可以指导对靶基因 mRNA 的多次切割而本身保持完整,这种作用方式与 siRNA 类似,miRNA 对基因的调控也是通过构成 RISC 来进行的,RISC 是其调控的物质基础。RISC 组成的核心成分是 miRNA或 siRNA 以及各种蛋白,其中 Ago 蛋白是该复合体中的核心蛋白,具有非常重要的作用。
4 miRNA研究方法
miRNA 基因及其调控的靶基因的表达,构成了一个非常严密的调控网络,这个网络的精确运行确保了生物体各种生理过程的正常运行。因此,miRNA 自身的表达与否,表达多少,及其对下游靶基因的调控均对 miRNA 行使特定功能具有重要意义。目前,对 miRNA 表达的鉴定仍然主要依靠以杂交和 PCR 为主的相关方法。对其功能线索的获得,则主要依赖于在特定细胞或动物模型内外源性抑制或表达相应的 miRNA 基因,再通过报告基因系统验证后检测特定细胞或动物模型发育过程中的生化或分子变化来实现。并同时利用报告基因系统对 miRNA 的靶基因进行验证。
(1)miRNA 分子的检测
由于miRNA 是一类很小的分子,部分miRNA 表达水平可能很低。因而需要极为灵敏的定性、定量分析方法。目前多采用Northern Blots的方法来检测 miRNA 的存在,此外还有 RT-PCR、Realtime-PCR 和 miRNA 芯片等方法。
① Northern Blots
Northern blots 是研究基因在 miRNA 水平表达的可靠手段,在基因表达的研究中被广泛应用。 Northern 杂交具有灵敏性高的特点,不仅可用于检测miRNA在组织细胞中的表达水平,还可结合使用RNA marker检测miRNA的分子大小,这对于排除其它小分子 RNA 的污染有重要意义。Northern 杂交也可作为 miRNA 定量的方法。通常,Northern 杂交后的放射自显影/化学发光方法常在 20~25 bp 区域显示成熟 miRNA 单一杂交带,有时则出现 2 条或 3 条条带,这是由 miRNA 前体加工过程中 RNA 双体(miRNA:miRNA* ) 剪切位点的细微差别所导致。此外,在 70~80 bp 位置有时也会出现 miRNA 前体杂交信号, 但并不稳定, 或许与总 RNA 质量有关。
Northern Blots 杂交的缺点是对 RNase 污染异常敏感,任一步操作不当都会严重影响实验结果。另外,Northern Blots 对样品的需求量较高,需要微克级样品才能避免假阴性,有时样品量达到 40 μg 才会出现明显杂交信号。
② miRNA 芯片技术
miRNA 芯片技术可以高通量的检测基因表达谱,它可以在短时间内同时鉴定所有已知 miRNA 的表达谱。最初的 miRNA 基因芯片,是将反义 DNA探针点在尼龙膜上,然后以 5’端放射性标记的 miRNA 样品杂交,再经放射自显影获得信号。通过芯片上的 miRNA 基因及对照序列,可精确的分析出样品中所有已知的 miRNA 的表达水平。目前,已有很多研究应用该技术建立了不同物种不同组织中 miRNA 的表达谱,亦有研究比较了正常组织和和疾病组织中 miRNA 表达谱的差异。但是 miRNA 芯片只能分析已知的miRNA 表达水平,不能分析未知的 miRNA。在芯片的基础上,Nelson 等提出一种称为 RAKE (RNA-primed, array-based Klenow)的方法,在特定的细胞中同时检测所有 miRNA 的表达谱,并且能够检测出福尔马林固定、石蜡包埋组织中的 miRNA 表达谱。尽管基因芯片技术敏感度有了很大提高,且可用于多个 miRNA 同时检测,但仍有不足:芯片检测的前提是分离得到高质量的低分子量 RNA 组分;基因芯片的制作和检测需要昂贵的仪器设备;结果是半定量的,重复性较差;不能同时优化所有待测 miRNA 的杂交环境,因而不能区分高度类似的 miRNA 等。
③ miRNA qRT-PCR
传统的 qRT-PCR 不适合于检测 miRNA 这种仅有 17~25nt 大小的小RNA,但通过特殊设计的 RT 引物,配合 qPCR 引物及探针就可以精确检测微量样品中 miRNA 的表达水平,也可以用于终点 RT-PCR 定性检测。Stem-loop 实时定量 RT-PCR 是一种高特异度、敏感度的检测 miRNA 表达的实验技术(图 6),包括用包括设计具有茎环( stem-loop )结构的反转录引物和用 miRNA 荧光标记的特异分子探针进行实时 PCR 2 个关键步骤。该技术相对其它 microRNA 检测技术有以下优点:高度特异性:可以只对成熟 microRNA 进行定量,有效区分成熟 microRNA 分子和前体分子以及其它成熟 microRNA 的同源分子;超宽的定量线性范围和高度的检测灵敏度:从几个拷贝到几万个拷贝,定量线性范围跨越 7 个数量级;样品消耗少:仅需1~10 ng 的总 RNA;适用范围广:总 RNA 、细胞裂解物以及纯化的 RNA都可用于 miRNA 的定量检测。也可用于其他小分子 RNA 的检测。
(2)研究 miRNA 的生物信息学方法
在 miRNA 研究领域中,生物信息学方法的广泛应用得益于对 miRNA 功能作用机制的深入阐明。目前,生物信息学在 miRNA 研究中的应用,主要集中在 miRNA 基因和 miRNA 靶基因的预测两个方面。
① miRNA 基因预测
随着人们对 miRNA 结构特点及保守性的逐渐了解,计算机预测正成为寻找新小 RNA 基因的主要方法。
目前,大部分的软件预测都主要依据 miRNA 在进化过程中的保守性及其茎环结构的前体来进行。在众多 miRNA 预测软件预测的大量候选 miRNA 基因中,只有少数已被实验确证,但没有被检测到表达的 miRNA 基因,并非一定就是假阳性结果,因为这些候选基因的表达模式可能尚未被人们所了解。
② miRNA 靶基因的预测
自从 2003 年第 1 个 miRNA 靶基因预测软件问世以来,至今已有数十种专业软件被用来预测 miRNA 靶基因。这些软件的计算法则通常是:①种子序列(miRNA 5'端 2~8nt)和靶基因 3'UTR 区之间的互补程度;②miRNA_靶基因二聚体的自由能大小,即热力学稳定性;③靶基因非翻译区序列跨物种的保守性等。目前预测 miRNA 靶基因的常用数据库有: miRBase、TargetSca、PicTar、miRanda 等。
③ miRNA 靶基因的鉴定
利用荧光定量 PCR 及 Western blot 方法分别检测转染或封闭 miRNA 后细胞中感兴趣的 mRNA 水平及蛋白水平的变化, 从而确定 miRNA 与靶基因的对应关系。这种方法能够直接鉴定出 miRNA 的靶基因, 准确度高,但不能鉴定 miRNA 的靶位点。
目前最常用的是构建荧光素酶报告基因载体。其基本原理是:在荧光素酶报告基因载体的报告基因编码区的下游插入含有靶基因的 3’UTR 区,然后将构建好的载体转染细胞并改变细胞中相应 miRNA 的表达水平,通过检测荧光素酶的表达情况以分析转染 3’UTR 中是否含有 miRNA 的靶位点。
长链非编码RNA(Long non-coding RNA, lncRNA)是一类本身不编码蛋白,长度在200-100000 nt之间的RNA分子的长链非编码RNA分子。它可在多层面上(表观遗传调控、转录调控以及转录后调控等)调控基因的表达。lncRNA最初被认为是RNA聚合酶II转录的副产物,是一种“噪音”,不具有生物学功能。研究表面,lncRNA参与了X染色体沉默、染色体修饰和基因组修饰、转录激活、转录干扰、核内运输等过程,其调控作用正在被越来越多的人研究。
1 LncRNA特点
(1)lncRNAs通常较长,具有mRNA样结构,经过剪接,具有polyA尾巴与启动子结构,分化过程中有动态的表达与不同的剪接方式。
(2)有组织特异性与时空特异性,不同组织之间的lncRNA表达量不同,同一组织或器官在不同生长阶段,其中的lncRNA表达量也会变化。
(3)调控多样性,lncRNA可从染色质重塑、转录调控及转录后加工等多种层面实现对基因表达的调控。lncRNAs启动子同样可以结合转录因子,如Oct3/4,Nanog, CREB, Sp1, c-myc, Sox2与p53,局部染色质组蛋白同样具有特征性的修饰方式与结构特征。
(4)序列上保守性较低,只有约12%的lncRNA可在人类之外的其它生物中找到。
(5)在肿瘤与其他疾病中有特征性的表达方式。
哺乳动物蛋白编码基因占总RNA的1%,长链非编码RNA占总RNA的比例可达4%-9%,这些长链非编码RNA是基因功能研究的又一座宝库。目前发现的许多lncRNA都具有保守的二级结构,一定的剪切形式以及亚细胞定位。它们在基因组上相对于蛋白编码基因的位置,可以分为5种:正义链(sense)、反义链(antisense)、双向(bidirectional)、内含子间(intronic)、基因间(intergenic),其所在的位置与其功能有一定的相关性。
2 LncRNA作用机制
长链非编码RNA的作用机制非常复杂,至今尚未完全清楚。根据目前的研究,lncRNA的作用机制如要有以下几种。
(1)编码蛋白的基因上游启动子区(橙色)转录,干扰下游基因(蓝色)的表达
(2)抑制RNA聚合酶II或者介导染色质重构以及组蛋白修饰,影响下游基因(蓝色)的表达;
(3)与编码蛋白基因的转录本形成互补双链(紫色),干扰mRNA的剪切,形成不同的剪切形式;
(4)与编码蛋白基因的转录本形成互补双链(紫色),在Dicer酶的作用下产生内源性siRNA;
(5)与特定蛋白质结合,lncRNA转录本(绿色)可调节相应蛋白的活性;
(6)作为结构组分与蛋白质形成核酸蛋白质复合体;
(7)结合到特定蛋白质上,改变该蛋白质的细胞定位;
(8)作为小分子RNA(如miRNA、piRNA)的前体分子。
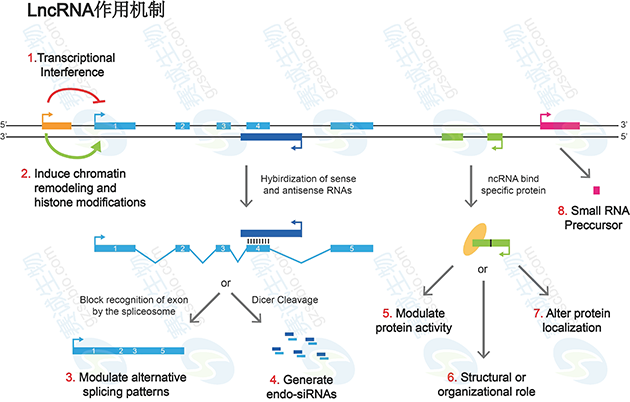
图8 LncRNA作用机制
3 LncRNA研究方法
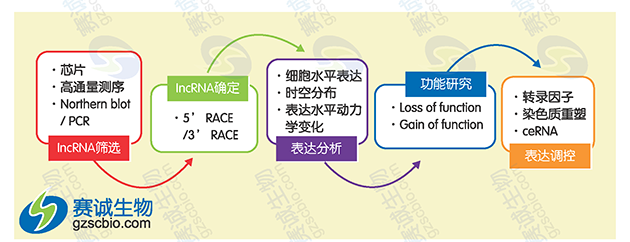
图9 LncRNA研究策略
(1)lncRNA筛选:通过lncRNA芯片或RNA测序等方法对多对疾病模型和对照样本组织进行lncRNA表达谱分析;通过生物信息学的方法筛选出具有表达差异的lncRNA,构建共表达网络,预测lncRNA的靶基因;通过PCR或Northern Blot技术对候选lncRNA验证,确定其表达差异。
(2)lncRNA全长克隆:可以通过5'RACE获取lncRNA 5'全长,3'RACE获取lncRNA 3'全长,最终拿到完整的lncRNA序列。
(3)表达分析。
细胞水平表达:在细胞水平进行检测表达差异。
组织分布:检测不同组织、不同阶段表达特性。
表达水平动力学变化:比较不同处理条件下,如药物处理、诱导处理下,表达水平差异。
(4)功能研究。
功能获得性研究:构建lncRNA过表达载体。
功能缺失性研究:可通过siRNA、shRNA、反义核酸等方法沉默lncRNA,干预 lncRNA后检测其对疾病相关基因表达影响和对细胞表型如增值、凋亡、侵袭、转移等的影响。
可通过RNA pull down、RNA-RIP、ChIRP-seq等方法检测与lncRNA结合的DNA、RNA、蛋白质。
表达调控:将lncRNA表达与其他领域相结合,解释lncRNA调控机理。
转录因子:研究lncRNA与转录因子的调控机制;
染色质重塑:lncRNA表观调控;
ceRNA机制:研究lncRNA-miRNA-mRNA三者之间的调控机制。
