
广州市天河区黄埔大道中124号2705室
电话:020-29031124
手机:18102256923
Email:servers@gzscbio.com
Fax:020-85625352
QQ:2913120624
最近的研究发现,miRNA表达与多种癌症相关,大约50%得到注解的miRNAs在基因组上定位于与肿瘤相关的脆性位点(fragile site)。这说明miRNAs在肿瘤发生过程中起至关重要的作用,这些miRNAs所起的作用类似于抑癌基因和癌基因的功能,有研究人员将miRNA命名为“oncomirs”。
细胞增殖失控或不适当存活引发癌症,其形成须经历三个阶段:正常细胞的遗传物质受到损伤;细胞分裂加快,进入癌变过程;肿瘤恶化甚至转移。处于发育期或已成熟的个体,细胞均已形成保护功能,以确保细胞的分裂、分化和死亡过程正确且协调地进行。癌症诱发因素与肿瘤相关基因的相互作用决定癌症的发生、发展和形成。科学家们一直试图在分子水平研究揭示癌症形成的分子机制,阐述癌症的诱发原因、发生、发展和形成的分子基础,希望能够有效控制和根治癌症。目前有关癌症产生的分子机制仍有待于进行广泛而深入的研究。
从前面miRNA 的形成作用机制看,miRNA通过特异性基因沉默导致靶mRNA 降解,抑制蛋白质的合成或在细胞分化、发育和凋亡等关键时期调控转录后的基因表达水平,既可能作为诱癌基因参与恶性肿瘤的发生和发育,又可能作为抑癌基因参与控制恶性肿瘤的形成。因此,加强miRNA 的功能与癌症形成的关联性研究具有重要意义。目前,已有超过186 种miRNA 基因被定位于肿瘤相关的染色体重排区,而一些特殊miRNA 表达基因的改变出现在部分癌症特有的染色体脆性位点中。生物信息学分析估计许多miRNA 的作用靶点是原癌基因或者抑癌基因,但这种估计还有待证实,出错几率可能高达30%。
表1 原癌基因和抑癌基因可能是miRNA潜在的作用靶点
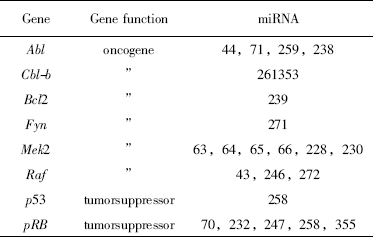
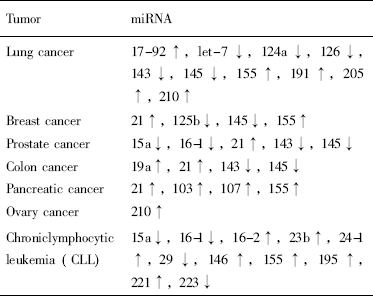
表2 肿瘤细胞中miRNA表达上调或下调情况
充当抑癌基因作用的miRNA:
mir-125b-1,位于染色体的11q24脆性位点,乳腺癌、肺癌、卵巢癌、子宫癌病人中11q924位点常有缺失,而这一位点并不存在已知的抑癌基因。
65%B细胞慢性淋巴型白血病(CLL)病人,50%的套细胞淋巴瘤病人,16-40%的骨髓瘤病人、60%的前列腺癌病人中有13q14位点的缺失。因此,在这个30Kb的区域中必定有一个肿瘤抑制基因的存在。而mir-15a和mir-16-1位于这一区域中一个功能未知的被称为LEU2的非编码蛋白的RNA基因的内含子区域。Climmino等报道,miR-15a和miR-16-1负调控BCL2,一个抗凋亡基因,因此,这两个miRNAs的缺失或下调,导致了BCL2表达的升高,促进了白血病、淋巴瘤和前列腺癌的发生。
有研究报道,mir-143和mir-145在结肠癌中明显下调。有趣的是,其发夹结构的前体分子在肿瘤和正常组织中含量相似,这表明,可能是由于其成熟过程受到破坏。mir-143和mir-145的肿瘤抑制基因功能不仅仅局限于结肠癌,在乳腺癌、前列腺癌、子宫癌、淋巴癌等细胞系中其表达量也明显下调。
Takamizawa等发现肺癌病人的let-7表达显著降低,并且这导致这些病人更差的预后,非小细胞肺癌病人的let-7表达水平越低,其预后越差,术后生存期越短。体外组织培养实验表明,在人的肺癌细胞中瞬时的表达let-7可以抑制细胞的增殖,这也说明let-7在肺组织中可能是一个抑癌基因。实验表明,在人类细胞中let-7通过3’非翻译区域直接抑制癌基因Ras的表达。大约有15-30%的人类肿瘤都含有Ras突变,而激活的突变导致这个蛋白表达上升可以引起细胞转化。因此,能够调节Ras蛋白表达的let-7,可以控制细胞的增殖速度。
充当癌基因作用的miRNA:
miR-21在胶质母细胞瘤中表达增加。这个基因在肿瘤组织中表达量比正常组织高5-100倍。反义核酸的研究发现这个miRNA通过抑制凋亡而并非影响细胞增殖控制细胞生长,这预示着这个miRNA具有癌基因的功能。另一项独立研究,利用芯片来检测肿瘤和正常组织的245个miRNAs的表达水平,也发现胶质母细胞瘤中miR-21表达升高。由于mir-21不是一个大脑特异性的基因,在乳腺癌样品中表达也有增加,这个基因可能在肿瘤发生中起到广泛的作用。
Metzler等人发现,在BIC基因上具有一段138个核苷酸的保守序列,编码mir-155的发夹结构。该研究组还发现在Burkitt淋巴瘤中,miR-155表达量上升了100倍,此外的研究也发现,Hodgkin淋巴瘤等肿瘤中miR-155水平也有提高。因此,mir-155可能是作为一个癌基因和MYC协同作用,而其正常功能是在B细胞的分化中起作用,其可能的靶基因是那些对抗MYC信号通路的基因。
He等人发表的论文发现在散布的B细胞淋巴瘤、滤泡型淋巴瘤、套细胞淋瘤等肿瘤中常常有13q31位点的扩增。而在这一扩增区域的唯一的基因就是一个非编码蛋白的RNA,C13orf25,这个转录本编码了mir-17-92基因簇,其中包含了7个miRNAs:miR-17-5p,miR-17-3p,miR-18a,miR-19a,miR-20a,miR-19b-1,and miR-92-1。他们由此推断,这个基因簇的过表达与肿瘤形成有关,而后通过实验研究证明,过表达Myc和mir-17-19-b1基因簇淋巴癌与仅有Myc过表达肿瘤相比较,具有更强的增殖能力,更低的细胞死亡率。这些实验证实,mir-17-19-b1中的miRNAs可以协同地行使癌基因的功能,其靶基因可能是在MYC过表达条件下激活的凋亡蛋白。当凋亡途径被mir-17-19-b1去除,MYC可以诱导细胞不受控制地增殖,这导致了肿瘤发生。
O’Donnell等人单独证明了mir-17-92基因簇是一组可能的肿瘤相关的基因。他们用miRNAs芯片筛选过表达MYC,B细胞系P493-6中miRNA表达变化。他们发现MYC诱导了mir-17-92的表达,而这些miRNAs可以抑制E2F1的翻译。在这一模型中,mir-17-92基因簇所起的作用似乎是抑癌基因的作用,这与上面讨论的He等人的发现是相反的。这其中可能的机理是,尽管E2F1可以促进细胞增殖,但是当E2F1的表达水平超过一阈值,它也可以引起凋亡,在此情况下,miRNAs对于E2F1的负调控可能是通过阻断E2F1的诱导凋亡活性,从而促进MYC介导的细胞增殖,支持了He等提出的模型。
