
广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
走向基因组3D世界 ——染色体构想捕获技术3C(chromosome conformation capture)
日期:2018-11-30 标签:染色体构象捕获,3C,4C,5C,HiC
在过去10年中,染色体构象捕获(chromosome conformation capture 3C)技术及其该技术的拓展技术(4C,5C,Hi-C, ChIA-PET),使人们能够以超强的分辨率和高通量测序分析细胞核内的三维立体结构
一、3C技术:走向三维(3D)基因组学的基础
1.交联:用甲醛交联染色质,固定蛋白与DNA,使染色质保持三维结构。
2酶切:再用一种限制性内切酶(HindIII、BglII、SacI、BamH或EcoRI)切割染色质,蛋白周围的互作基因切开。使互作DNA与其他非互作DNA分离。
3连接:重新连接交联DNA片段的粘性末端。互作DNA的两端具有相同的粘性末端,可以互相连接形成loop。
4 PCR:第3步形成的loop有两种,一种是同一基因间的loop,一种是互作基因间的loop,用PCR的方式区分这两种loop。
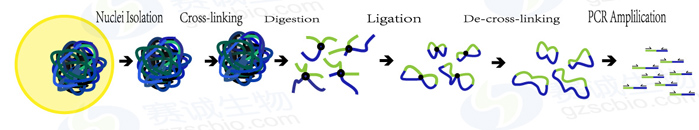
Fig.1染色体构象捕获(3C)过程
二、3C的延伸:4C,5C,Hi-C, ChIA-PET
3C技术主要是研究点对点的基因互作,即特定的两个基因间的互作,如基因A与基因B的互作。如果我们想研究一个基因与多个基因互作,或多个基因与多个基因互作呢?这就衍生出了4C,5C,Hi-C技术。如果我们想知道特定蛋白下的基因互作呢?这就衍生出了ChIP-loop和ChIA-PET。
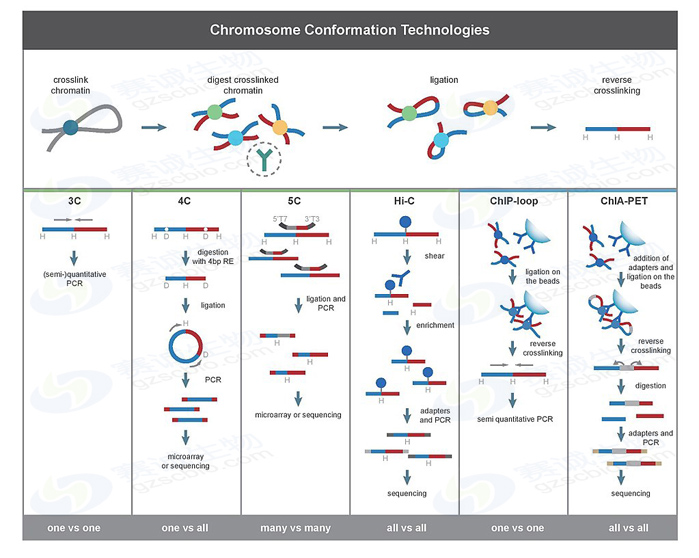
Fig.2 3D基因组研究方法综述
◆3C (one-vs-one)
主要研究点对点的基因互作
◆4C (one-vs-all)
主要研究一个特定基因与其所有互作的基因的互作。4C是在3C基础设计了双酶切位点,然后通过成环的形式,保证了只需要设计1对引物,就可以检测1个位点对多个位点的相互作用。 最后一个C为circle,环化,这也是4C中最关键的一步。
◆5C (many-vs-many)
主要多基因与多基因的互作。5C技术是在4C的技术上,加了个tag标签,导致可以检测many-to-many的相互作用。
◆Hi-C (all-vs-all)
Hi-C使用了高通量测序的方法,理论上它能够捕捉到所有的基因间的互作。HiC基本步骤是,甲醛交联,限制酶切,末端补平加biotin,平末端连接,超声破碎,biotin富集,建库测序。整个过程是没有特异性引物存在的。而且依靠高通量的测序技术,Hi-C可以展现出,整个染色体all-to-all的互作关系。
◆ChIP-loop (one-vsone)
ChIP-loop是使用特异性抗体捕获蛋白,检测与这个蛋白特异结合的两条DNA,连接两条互作DNA,形成loop,再进行PCR检测。(ChIP+3C)
◆ChIA-PET (all-vs-all)
ChIA-PET 是用抗体将目标蛋白捕获下来,然后加入adapter后,再进一步用Hi-C方法得到通过目标蛋白进行相互作用的所有基因(ChIP+adapter+Hi-C)
三、应用案例
应用一:3C
3C技术已经在β-珠蛋白中得到证实:
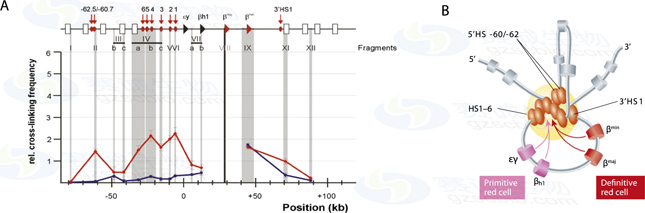
Fig.3
3C数据和ACH active chromatin hub活性染色质中枢。(A)3C数据展现小鼠β-珠蛋白基因附近的增强子loop。此图展现的是β-major基因与其他染色质的互作位点,β-major基因为3C的锚定点,灰色区域为检测的互作区域,红色箭头所指为强结合位点,即形成loop的区域,红色折现表示胎鼠肝脏组织中的基因间的互作强度,蓝色折现表示胎鼠大脑中的基因间的互作强度,胎鼠肝脏中β-珠蛋白基因为激活状态,形成loop,胎鼠大脑中β-珠蛋白基因为沉默状态,未形成loop,(b)基于b-globin locus位点的各种3C实验,提出了ACH模型。示意图显示了β-珠蛋白基因活化时的染色质构想。
应用二:4C
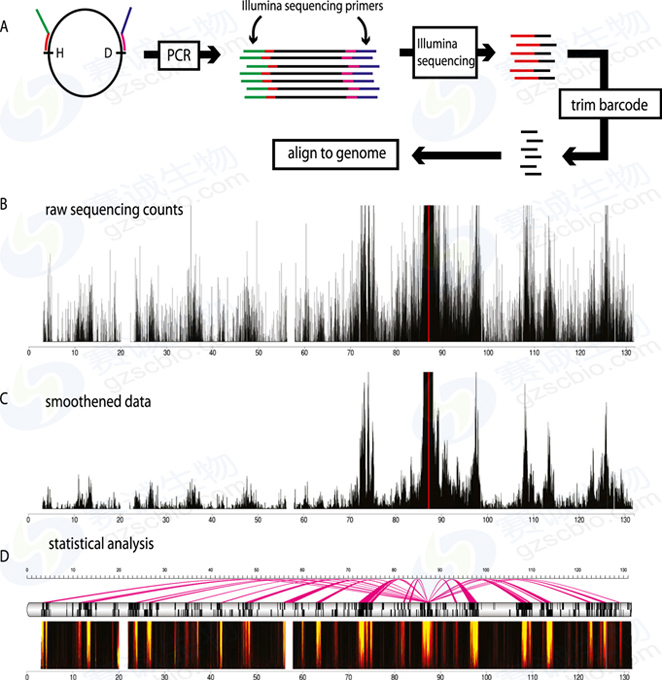
Fig.4
(A)在4C-seq中,在成环处设计测序特异引物PCR,可以使得产物可以在不用建库的情况下测序。读数包含引物和连接节点。在去除引物序列后,其余的读数与基因组比对。(B)染色体图显示小鼠RAD23位点在神经前体细胞中的原始4C-seq统计。4C剖面显示了侧向的特征峰。(C)利用窗口化方法,例如运行平均值或中值,对数据应用低通滤波器,从而可以基本上无噪声地观察染色体相互作用。(D)最后,可以采用高级分析,例如用于可视化的域图或基于错误发现率(FDR)的方法来识别统计上显著的相互作用。域图是在给定区域中富集4C捕获的多尺度表示。高亮区域显示显著富集4C捕获的基因组区域。基于FDR的方法可用于识别显著富集的区域。红色的弧线显示与哪些基因形成了连接节点。
应用三:5C与Hi-C
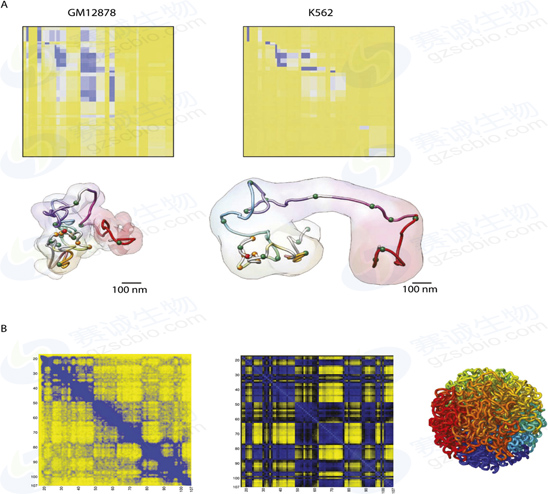
Fig.5
5C和HiC提供相互作用频率的矩阵。(A)对非活性和活性a-globin locus (顶部)周围500kb的5C结果进行建模,以表明活性位点采用更开放的构象,而在非活性状态下,该位点显示封闭构象(底部)。(b)基于HiC数据,可以绘制染色体宽的相互作用频率矩阵。示出具有1-MB分辨率(具有100 kb的步长)的人类染色体14的接触图。中间面板显示格子状图案,这是HIC分析方法的最终结果。右边的面板显示了一个分形球体,一个基于HiC数据和理论分析的人类染色体组织模型。
应用四:ChIA-PET
ChIA-PET最近被应用于揭示CTCF介导的相互作用体在小鼠胚胎干细胞(ESC)中的作用。由CTCF形成的识别环能够将增强子与启动子分开,以及活性染色质与非活性染色质分开,因此对于其绝缘子功能或促进远端增强子与基因之间的通信非常重要(fig 6)。
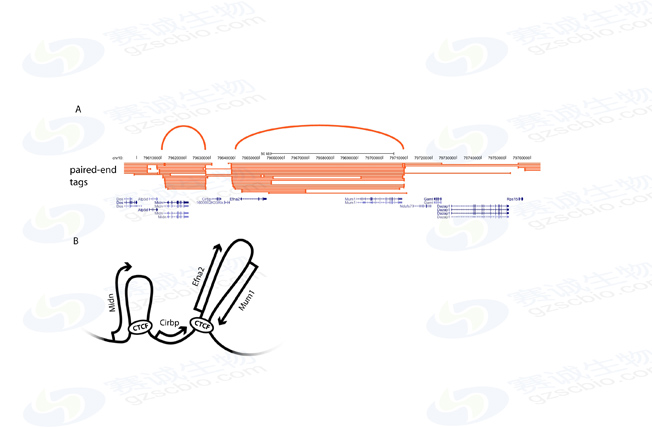
Fig.6
CHI-PET为CTCF蛋白的染色体互作提供了深入的了解。(a)三个ChIA-PET文库,用于分析绝缘体蛋白CTCF与染色体结合的结果。配对末端标记显示两个结合位点之间可能的相互作用。在基因组位点之间形成弧形突出环。(b)在A中显示的轨迹折叠的可能模型的示意性表示。
四、结语
我们生命体中的染色体不是线性的、一维的,而我们现在大部分转录调控水平的实验方案设计,都是基于一维线性模型上设计的,这样很有可能出现一些结果偏差,因此现在很多数据库,也开始考虑加入基因远程调控的影响。
为了真正了解基因组调控机制,需要基于3C技术,将我们基因组中的线性DNA信息转换为有功能性3D-基因组网络。3D基因组的研究在个体发育、在表观遗传、在肿瘤行成转移、在衰老,这些领域中有着重要的研究意义。也许你的基因看上去没变化,但是你就不一样。
参考文献:Tolhuis B, Palstra RJ, Splinter E, Grosveld F and de Laat W. Looping and interaction between hypersensitive sites in the active beta-globin locus. Mol. Cell. 2002,?10?(6): 1453–1465.?PMID?12504019.?doi:10.1016/S1097-2765(02)00781-5.
