
广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
DNA甲基化文献赏析之二: DNA甲基化维持障碍是胚胎干细胞全局去甲基化的主要原因
日期:2020-03-05 标签:DNA甲基化,胚胎干细胞

全局去甲基化是表观遗传重编程为幼稚多能性的保守程序的一部分。从引发高甲基化的胚胎干细胞(ESC)到多能性的低甲基化胚胎干细胞(血清→2i)的转变是表观遗传重编程的有价值的模型系统。在目前的研究中,作者重新审视了这一转变,提出了一个准确预测全局DNA去甲基化动力学的数学模型,以揭示和验证DNA去甲基化机制的不同组成部分之间的动力学和相互作用,并揭示负责全基因组DNA去甲基化主要途径的调节机制。实验上,本研究证明了全局去甲基化的主要驱动因素既不是活性去甲基化机制(Aicda,Tdg和Tet1-3),也不是从头甲基化的减少。UHRF1蛋白是DNMT1的必需靶向因子,在转变为2i时表达减少,因此维持性甲基化机制向复制灶的募集也减少。同时,H3K9me2(这是UHRF1与染色质结合所必需的)的全局性丢失,以复制偶联的方式协同地实施全局DNA低甲基化。
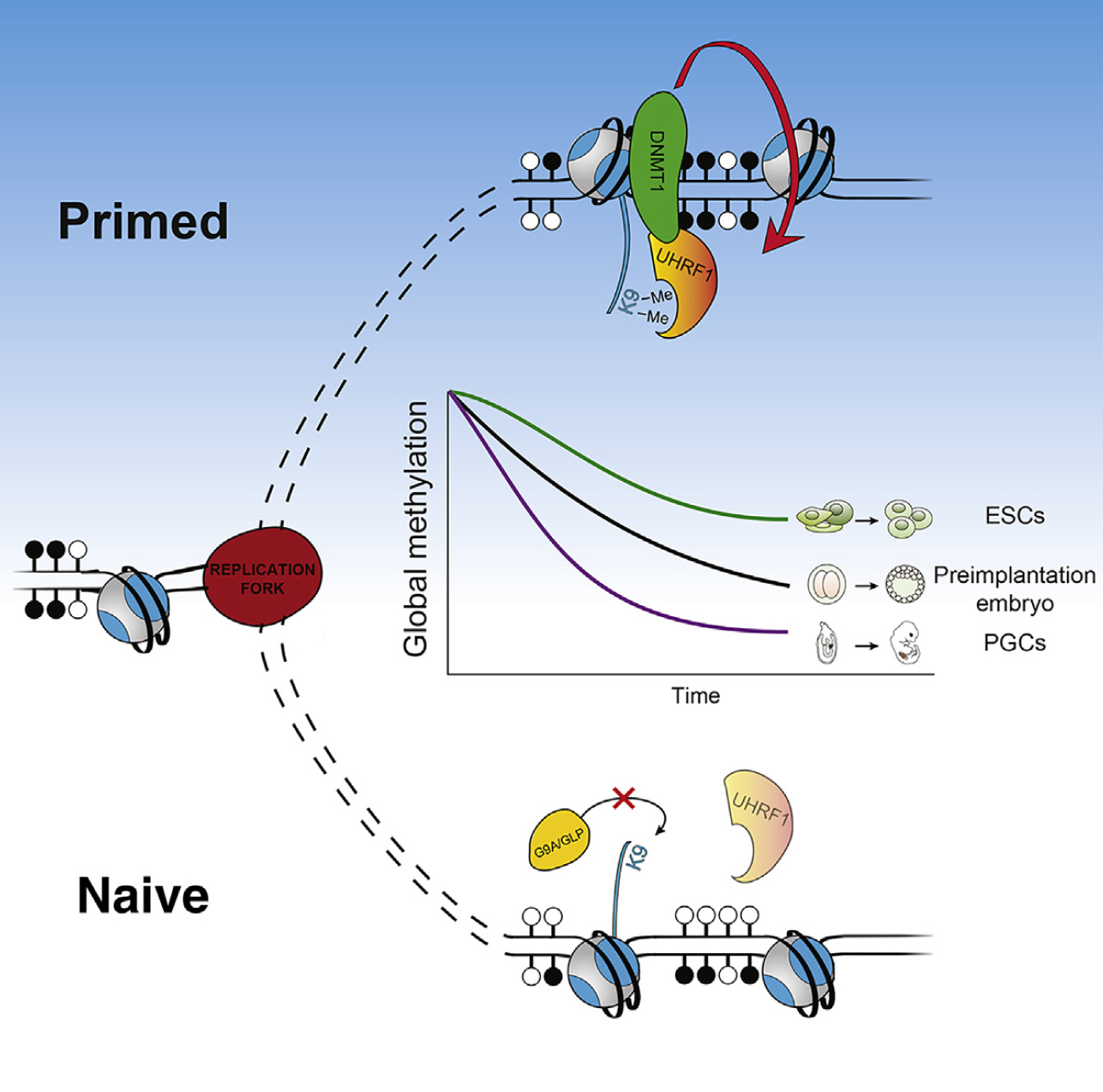
图X 调控通路模型。在血清细胞中,UHRF1通过H3K9me2染色质标记与半甲基化DNA结合而募集Dnmt1到复制灶维持DNA甲基化。血清到2i条件转换导致5mC的被动损失蛋白质水平的UHRF1下调和H3K9me2的丧失导致复制灶的募集受损。
DNA去甲基化动力学可归因于三种主要途径:( 1)维持DNA甲基化或复制依赖性被动稀释,(2)从头DNA甲基化,和(3)活性DNA去甲基化,主要通过DNA羟甲基化(图1A)。在从血清到2i ESC的转化期间,维持甲基化组分Dnmt1和Uhrf1,十一十一易位(TET)酶(Tet1,Tet2,和低水平Tet3),Aicda和Tdg,这些都以相似的转录水平表达涉及在活性DNA去甲基化中。相反,从头甲基酶Dnmt3a / b及其调节剂Dnmt3在2i状态下被抑制(图1B)。为了进一步了解从血清到2i ESC的转变动力学,作者在几个时间点确定了它们的DNA甲基化状态。首先,通过液相色谱-质谱(LC-MS)(图1C)以及还原代表亚硫酸氢盐测序(RRBS)(图1D)等方法量化5-甲基胞嘧啶(5mC)和5-羟甲基胞嘧啶(5hmC)的总体水平,DNA的去甲基化在培养基替换后(32小时;约两轮复制)迅速发生,然后逐渐继续,达到稳态14天后水平(图1C)。而在72小时内观察到5hmC水平的适度增加表明存在TET活性。
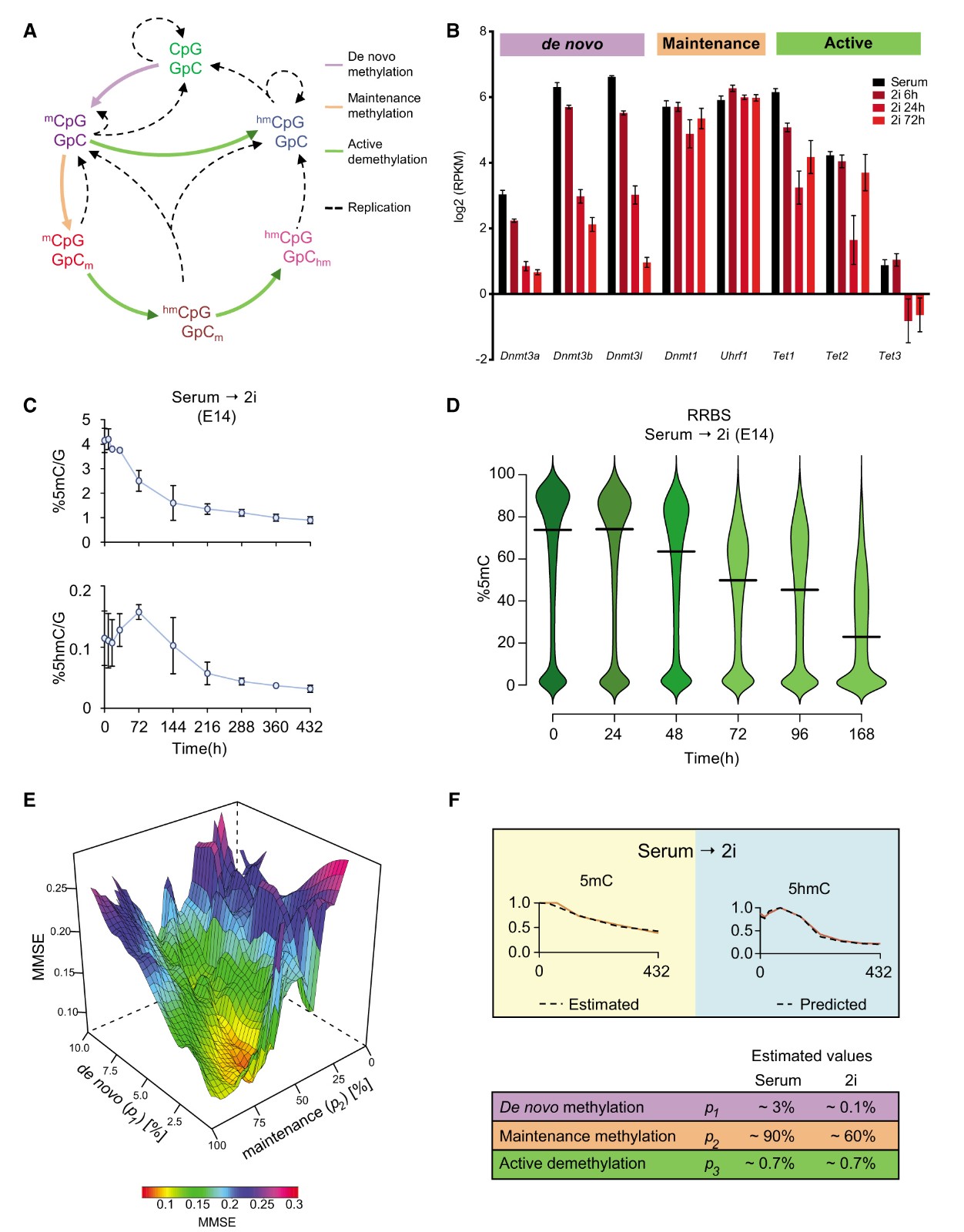
图1 小鼠胚胎干细胞血清转2i转化过程中5mC和5hmC的动态调节
(A)胞嘧啶甲基化/去甲基化循环的示意图。指出了不同形式的修饰的CpG二元体和相应的方法。
(B)在血清到2i转变期间参与DNA甲基化机制的基因的表达水平。
(C)在血清至2i转化期间通过LC MS在E14中测量的5mC(上)和5hmC(下)的百分比。
(D)在血清至2i转化期间通过EBS中的RRBS测量的5mC甲基化的百分比。 水平条代表中值。
(E)数学建模的图形表示。针对从头甲基化(p1)和维持甲基化(p2)的不同值绘制最小均方误差(MMSE)。
(F)在血清到2i转化期间,在E14中从LC-MS获得的实际测量(红线)覆盖数学模型预测(虚线)。该表总结了数学建模的结果,显示了血清稳态和2i中p1,p2和p3的估计值。p1,每平均细胞分裂成为半甲基化的未甲基化CpG的比例; p2,每平均细胞分裂完全甲基化的半甲基化CpG的比例;和p3,每平均细胞分裂变成羟甲基化的甲基化CpG的比例
为了剖析这三种途径的作用和相对贡献以及所涉及的各种调节因子,作者使用数学模型来预测整个时间过程中的DNA去甲基化。计算了完全甲基化的CpG二元组(mCpG/GpCm),半甲基化的CpG二元组(mCpG/GpC)和未甲基化的CpG二元组(CpG/GpC)的百分比以及羟甲基化的CpGs的水平。来自TAB-seq数据和RRBS测序,这些输入值以及来自LC-MS的全局5mC值用于估计以下参数,这些参数与酶丰度和/或活性成正比并反映转化为产物的底物量:p1,动态从头甲基化的比例值; p2,维持甲基化的比例常数;和p3,活性去甲基化(羟甲基化)的比例常数。通过将数学模型拟合到5mC数据的若干次迭代,能够估计具有最低最小均方误差(MMSE)的E14ESC中血清到2i转变的常数值(图1E)。p1,p2和p3反映了三种途径对观察到的DNA甲基化动力学的个体活性和总体贡献,并预测维持甲基化显着受损并且观察到DNA去甲基化的主要驱动因素(图1F)。
为了验证并充分了解单个DNA甲基化和去甲基化酶在全基因组表观遗传重编程中对血清向2i ESC过渡的贡献,作者检测了对各DNA甲基化机制的成分进行敲除后的小鼠胚胎干细胞在血清中几个时间点和从血清到2i ESC过渡期间的DNA甲基化状态(图2A),并将其与模型的预测进行比较。在血清→2i转换过程特别比较了缺乏Dnmt1或Uhrf1的胚胎干细胞与对照胚胎干细胞的去甲基化率,并观察到去甲基化率增加(图2B),表明DNA甲基化维持的丧失导致去甲基化率增加。这支持了数学模型(彩色框中的虚线)的预测,并暗示了2i ESC中DNA甲基化维持的丢失,尽管不是完全丢失。接下来,比较了缺乏Dnmt3a和Dnmt3b的胚胎干细胞的去甲基化动力学,血清培养的胚胎干细胞中Dnmt3a/b的缺失导致5mC的基因组水平仅略微下降(图2C),并且DNA去甲基化的动力学未改变。在血清到2i的转化中的检测表明从头甲基化的缺失不是DNA甲基化全局丧失的原因(图2D)。最后,作者评估了参与活性去甲基化途径的酶在血清到2i转化中的贡献。如模型所预测的,缺乏Tet1 / 2/3,Tdg或Aicda的ESC与其野生型对照显示出非常相似的去甲基化动力学(图2E)。由于先前已经提出TET驱动的氧化作为血清转2i转化中去甲基化的潜在驱动因素,作者证实了Tet1 / 2/3敲除(KO)细胞中5hmC的损失(图2F)。这表明TET酶在血清到2i转化过程中活跃地氧化5mC,但对于全局DNA去甲基化来说既不充分也不必要。
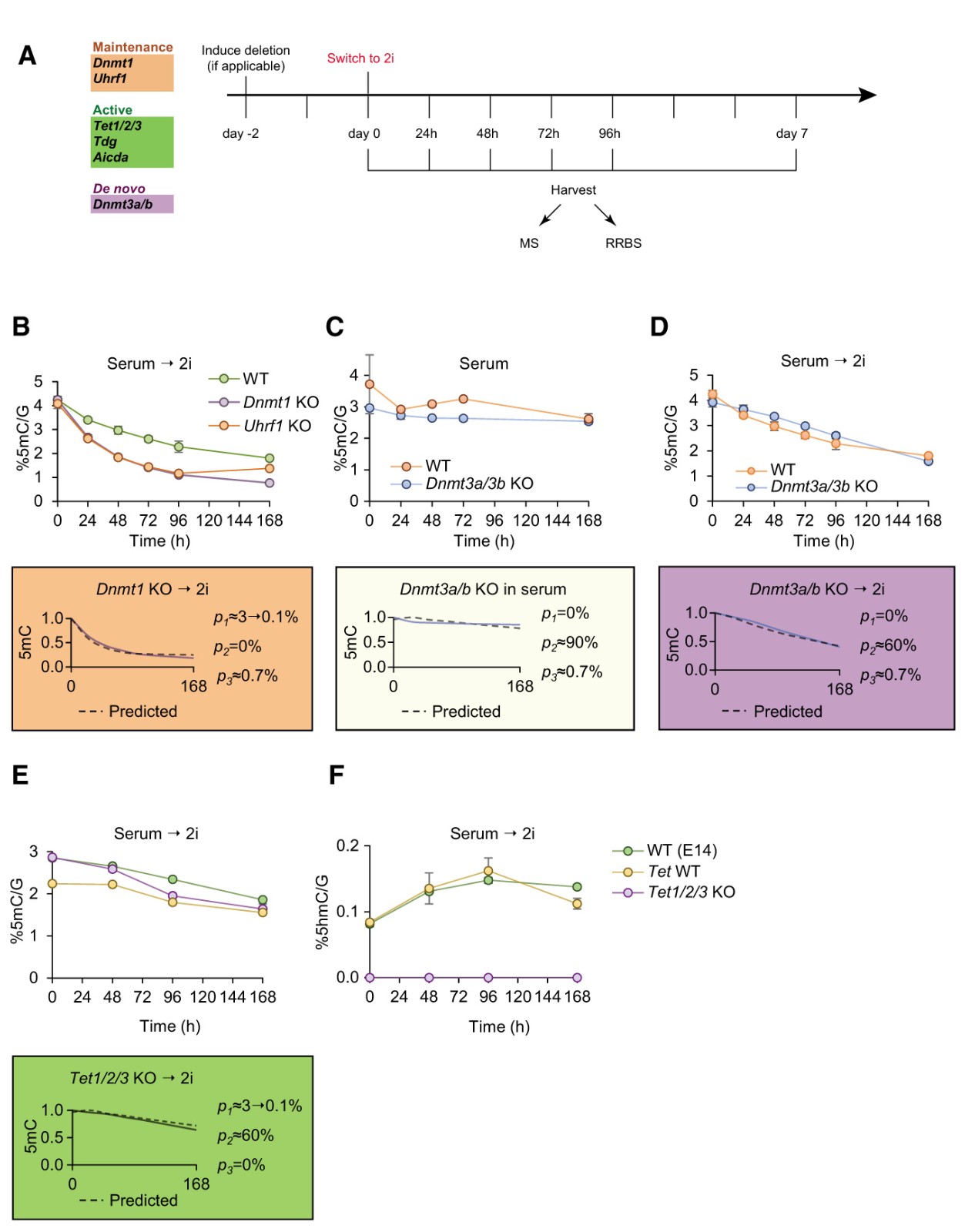
图2 DNA甲基化机制突变体的全球去甲基化动力学
(A)实验设计的示意图。
(B)通过质谱法测量的在血清至2i转变期间Uhrf1和Dnmt1KO ESC中5mC的水平。
(C)通过质谱法测量的血清培养基中缺失诱导后诱导型Dnmt3a/b KO中5mC的水平。
(D)在血清至2i转换期间诱导型Dnmt3a/b KO中5mC的水平。
(E)通过质谱法测量的血清至2i转变期间Tet1/2/3 KO和对照中5mC的水平。
(F)通过质谱法测量的在血清至2i转变期间Tet1/2/3 KO中和对照的5hmC水平。
有研究表明血清-2i转换期间5hmC水平升高以及维生素C(vitC)处理的2i胚胎干细胞中进一步显示TET依赖性低甲基化,提出了TET蛋白可能有助于去甲基化的可能性。作者在血清到2i转化期间的几个时间点测定了vitC存在或不存在的情况下 5mC和5hmC的水平(图3A),并观察到vitC处理后5hmC显着增加,这导致加速率去甲基化和进一步的全局低甲基化。为了证实这种效应是TET依赖性的,检测了在vitC存在或不存在的情况下Tet1/2 KO细胞中5mC和5hmC的水平(图3B),表明去甲基化(和羟甲基化)的增加速率取决于TET蛋白的活性。随后分析了5mC和5hmC在功能不同的基因组区域的分布(图3C),血清中富含5hmC,并将启动子分为高、中、低CpG密度启动子(分别为HCP,ICP和LCP),在没有vitC的情况下,5mC/5hmC水平相对于任何三类启动子的变化很小。然而,在存在vitC的情况下,早在4小时就已经明显转化5mC至5hm,并且5mC损失的速度与CpG密度相关并且对于每个类别是不同的。增强子,定义为重叠H3K4me1,H3K27ac和DNaseI超敏反应的元素,在血清胚胎干细胞中显示10%-40%5mC水平,与之前的研究结果一致,增强子的5mC丰度低,并且遵循类似于LCP的动力学。基因组的最大部分表现与LCP相似;转化为5hmC和随后的擦除非常缓慢(图3C)。最后,分析了Tet1/2/3 KO细胞中的甲基化,使用k-means聚类对基因组中平均DNA甲基化分析(图3D),这些区域在Tet1/2/3 KO细胞中具有更高的5mC水平,但无法鉴定与他们相关的任何显著功能的富集。
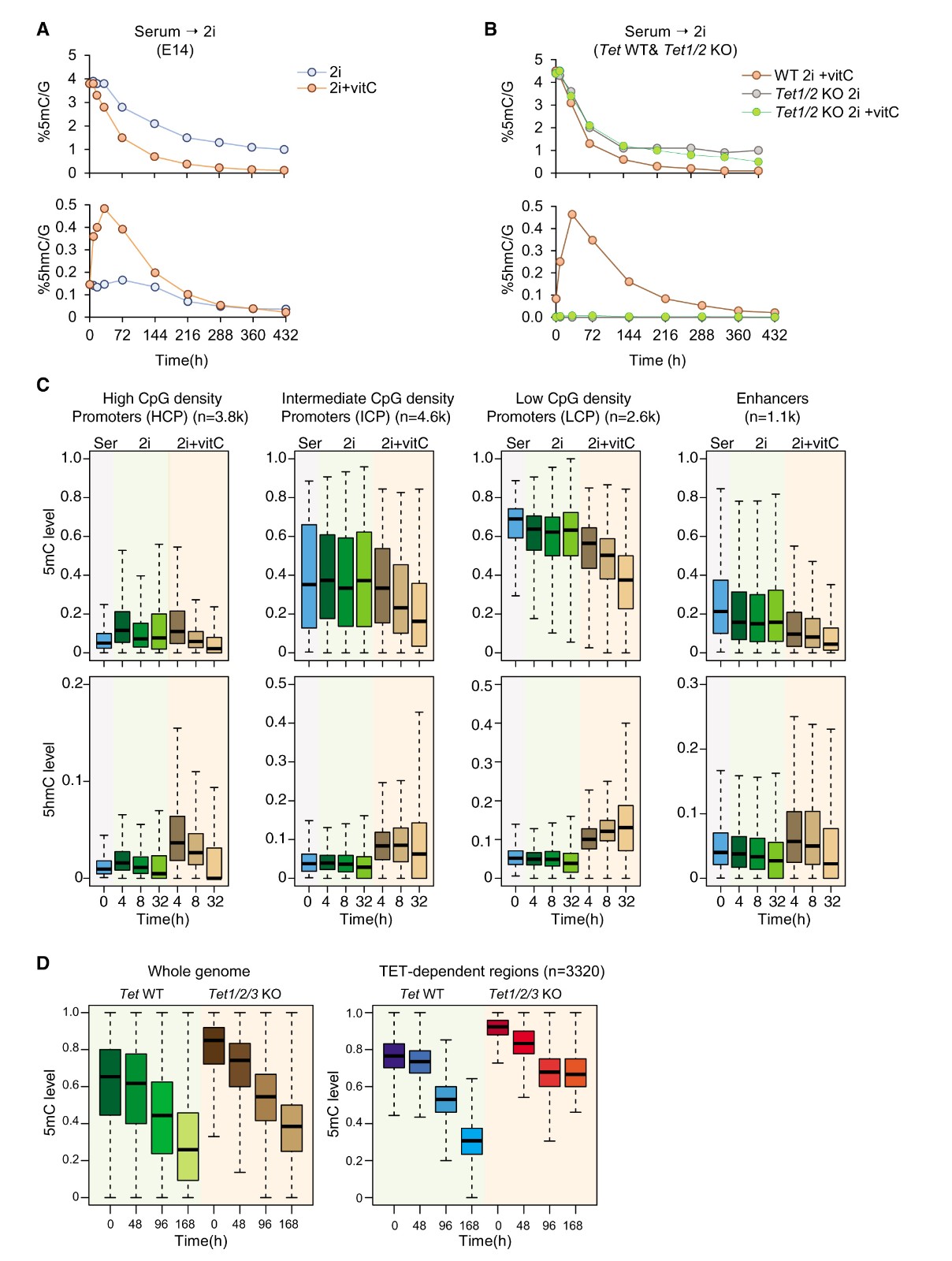
图3 血清-2i胚胎干细胞重编程过程中TET依赖的去甲基化动力学
(A)在不存在(蓝线)或存在vitC(红线)的血清至2i转变期间,通过LC-MS在E14中测量的5mC(上)和5hmC(下)的百分比。
(B)在不存在(灰线)或存在vitC(绿线)的情况下,在血清到2i转变期间通过LC-MS在Tet1/2KO中测量的5mC(上)和5hmC(下)的百分比。
(C)通过WGBS和TAB-seq在高CpG下测量的从血清(灰色)到2i(绿色)或2i+vitC(橙色)重编程的前32小时期间5mC(上)和5hmC水平(下)的高CpG启动子(HCP),中CpG启动子(ICP),低CpG启动子(LCP)和增强子。对于每类基因组元件,仅考虑在血清中具有5hmC富集的子集。
(D)Tet1/2/3 KO细胞和相应对照细胞(Tet WT)中的平均甲基化水平。使用k均值聚类鉴定Tet依赖性区域。
通过数学模型预测维持甲基化显着受损并且观察到DNA去甲基化的主要驱动因素(图1F)。随后,证实了Dnmt1或Uhrf1缺失后的快速去甲基化(图2B),并且还显示从头甲基化的丧失不能解释观察到的去甲基化动力学(图2C和2D)。为了理解这种损伤的机制调节,作者关注维持性甲基化机制的各个组成部分,特别是Uhrf1的作用。据报道在原始生殖细胞中,维持甲基化部分受到UHRF1核排除的影响。作者分析了UHRF1和DNMT1在血清和2i中生长的ESC中的亚细胞定位(图4A),没有检测到ESC中UHRF1或DNMT1的任何核排斥。然而,观察到2i样品中UHRF1蛋白的信号强度降低。在对血清到2i转换的细胞的初始转录组学分析显示Dnmt3a和Dnmt3b以及催化失活的调节同种型Dnmt3l的表达在2i中显着降低,而Uhrf1 mRNA水平未改变(图1B)。相反,在2i ESC中,UHRF1蛋白水平显着降低(通过蛋白质印迹3倍;通过定量质谱法2倍)(图4B-4D),同时发现UHRF1在血清和2i ESC中的异质表达(图4C),可归因于UHRF1的细胞周期依赖性调节。为了进一步证实UHRF1在蛋白质水平受到调节的观察,我们构建了具有UHRF1-GFP融合蛋白的组成型过表达的ESC系,与对内源性UHRF1的观察相似,UHRF1-GFP细胞系的荧光激活细胞分选(FACS)分析显示UHRF1-GFP在血清ESC中表达,但在血清至2i转化后迅速丧失(图4E)。
2i条件下UHRF1蛋白的快速但不完全的丢失,那么其是否损害了复制灶的DNA维持甲基化机制的募集?在缺乏Uhrf1的细胞中的先前实验证明,UHMF1的存在对于将DNMT1募集到复制灶是绝对必需的。作者通过在UHRF1和EdU的共染色计算具有EdU阳性病灶的细胞数量,用于UHRF1与复制灶的共定位。虽然UHRF1与血清条件下的大多数细胞中的EdU阳性复制灶共定位,但在2i条件下该数量显着降低(图4F),表明血清到2i转化中的DNA去甲基化是由于UHRF1将DNMT1募集到复制叉受损而导致DNA甲基化维持受损的结果。
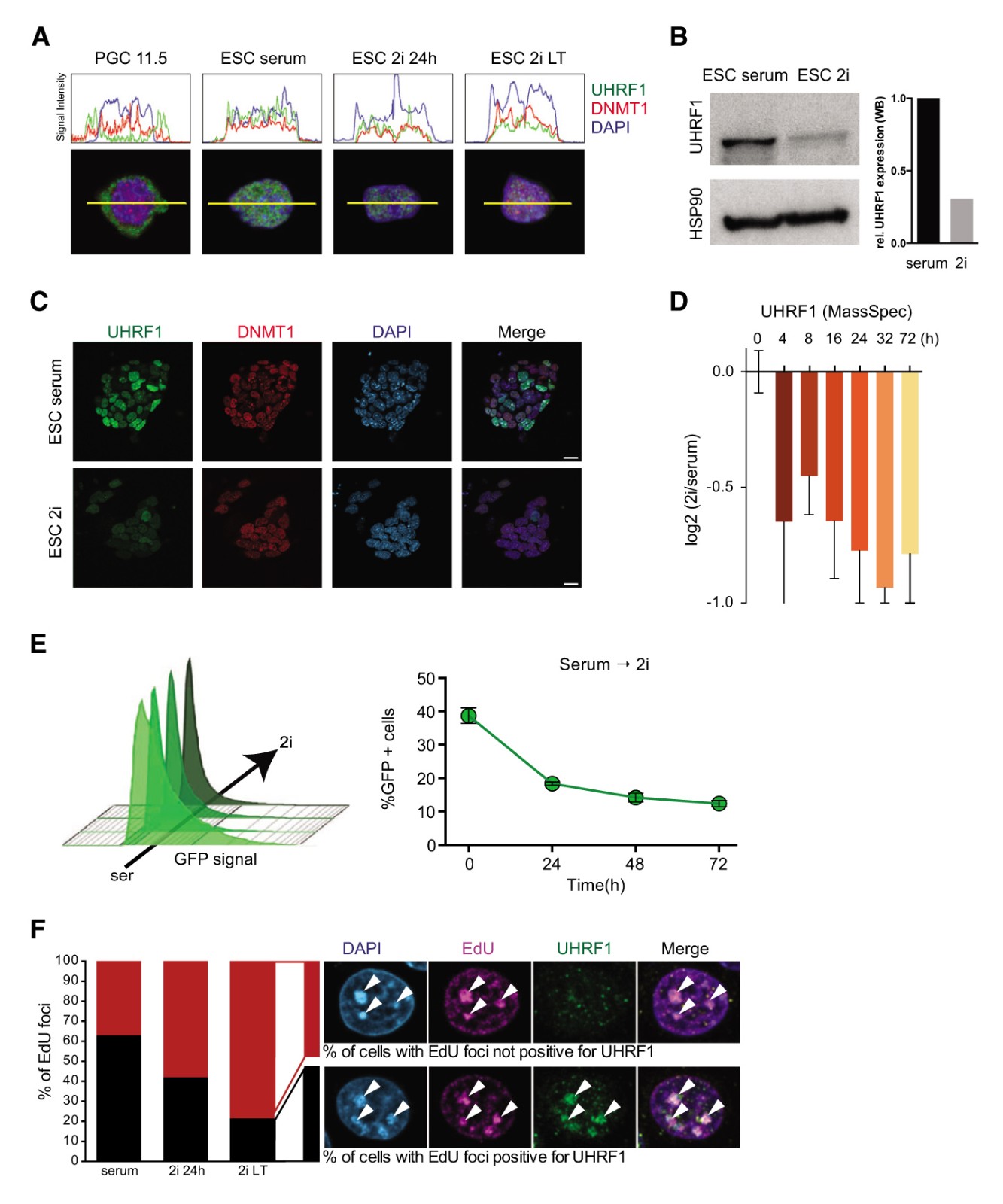
图4 UHRF1在2i中的蛋白质水平受到调节
(A)UHRF1(绿色)和DNMT1(红色)的细胞定位。DAPI(蓝色)标记核。
(B)Western印迹分析。
(C)血清和LT 2i ESC中UHRF1(绿色),DNMT1(红色)和DAPI(蓝色)的免疫荧光染色。
(D)相对于血清ESC,在血清至-2i转化期间的不同时间点通过蛋白质质谱法(无标记定量[LFQ])检测的UHRF1的蛋白质水平。
(E)血清-2i转化期间ESC中UHRF1-GFP融合蛋白的FACS分析。直方图显示转换期间不同时间点的GFP信号强度。黑色箭头表示用于量化GFP +细胞百分比的阈值,如折线图所示。
(F)在血清,24小时2i和LT2i ESC中的共定位的复制灶的百分比。来自血清ESC的图像显示两种定量状态的实例;箭头表示EdU +复制焦点
UHRF1的募集依赖于通过其SRA结构域识别半甲基化的CpG和通过其Tudor结构域识别组蛋白3赖氨酸9的甲基化(H3K9me2)上。H3K9甲基转移酶G9a的缺失导致全球DNA甲基化的丧失,H3K9甲基化的丧失特别是H3K9me2,是导致全基因组去甲基化的另一关键步骤。检测发现血清到2i转化后H3K9me2水平显着降低(2倍减少)(图5A,5B)。有趣的是,H3K9me2的丢失很快,并且检测到H3K9me2的全局水平与血清ESC中的DNA甲基化之间的IF之间的弱相关性(图5C),这与H3K9me2依赖性UHRF1募集在其中起关键作用的观点一致。为了解H3K9me2丢失的基因座特异性影响,进行了H3K9me2的ChIP-seq分析。为了将H3K9me2的存在与5mC的水平相关联,进行H3K9me2染色质免疫沉淀,然后进行亚硫酸氢盐测序(ChIP-BS-seq)。与相应的输入样品相比,H3K9me2结合的DNA中血清ESC和2i ESC中的5mC水平显着增加(图5D)。将基因组分成具有高或低H3K9me2富集的区域,发现H3K9me2高区域的5mC水平显着增加(图5E)。接下来在Uhrf1与相应的野生型对照ESC的RRBS文库在H3K9me2区域上测量5mC水平发现这些区域以UHRF1依赖性方式在2i ESC中保留高水平的DNA甲基化(图5F)。血清到2i转化过程中H3K9me2水平是如何调节的?作者通过质谱法的蛋白质水平(图5G)量化关键H3K9甲基化酶和去甲基化酶的mRNA水平,发现几种H3K9去甲基化酶,包括KDM3A,KDM3B和KDM4A,在2i条件下特异性地在蛋白质水平上调。相反,许多H3K9甲基化酶,例如EHMT1(GLP)和EHMT2(G9A)被下调。
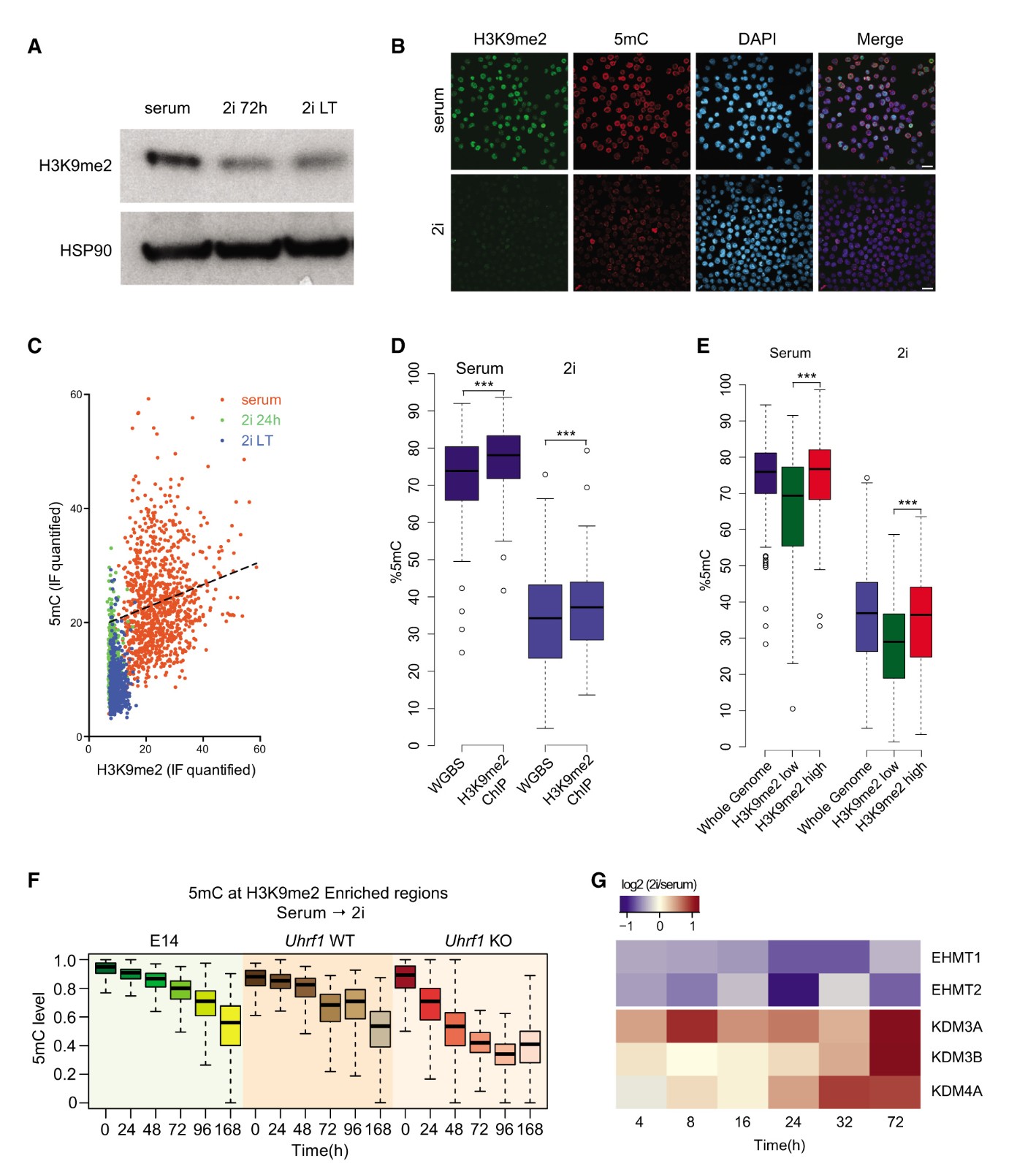
图5.H2K9me2在2i ESC中迅速减少
(A)血清和2i ESC中H3K9me2的Western印迹分析。
(B)血清和2i ESC中H3K9me2(绿色),5mC(红色)和DAPI(蓝色)的免疫荧光染色。
(C)血清,24小时2i和LT 2i ESC的免疫荧光染色中H3K9me2和5mC的定量信号的相关性。
(D)通过H3K9me2-ChIP-BS-seq测量H3K9me2结合的DNA中的5mC水平
(E)在血清和2i ESC中具有高或低H3K9me富集的区域中的5mC水平。
(F)在E14,Uhrf1 WT和Uhrf1 KO ESC中的血清-2i转变期间由RRBS在富含H3K9me2的区域测定的5mC的水平。
(G)在血清至2i转化期间的不同时间点通过蛋白质质谱法检测的已知H3K9修饰物的相对蛋白质水平。
最新DNA甲基化修饰:
- DNA甲基化文献赏析之三: TET酶通过对Aicda超级增强子上的5-hmC修饰增强活化诱导的脱氨酶(AID)表达
- DNA甲基化文献赏析之一: TET1介导FOXA1依赖性增强子的活跃表观遗传修饰
- Dicer promotes tumorigenesis by translocating to nucleus to promote SFRP1 promoter methylation in cholangiocarcinoma cells
- Epigenetic silencing of microRNA-137 enhances ASCT2 expression and tumor glutamine metabolism
- Transcriptional and Epigenetic Regulation of KIF14 Overexpression in Ovarian Cancer
