
广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
DNA甲基化文献赏析之一: TET1介导FOXA1依赖性增强子的活跃表观遗传修饰
日期:2020-03-04 标签:TET1,FOXA1

Forkhead box A1(FOXA1)是一种FKHD家族蛋白,在谱系特异性增强子激活和基因转录中发挥着先锋作用。通过全基因组定位分析,显示FOXA1的表达和占据反过来是维持DNA低甲基化和组蛋白3赖氨酸4甲基化这些表观遗传特征所必需的。从机理上讲,这涉及TET1(5-甲基胞嘧啶双加氧酶)。研究者发现FOXA1通过直接结合其顺式元件诱导TET1表达。此外,FOXA1通过其CXXC结构域与TET1蛋白FH结构域相互作用。因此,TET1共同占据FOXA1依赖性增强子并介导局部DNA去甲基化和伴随的组蛋白3赖氨酸4甲基化(H3K4me2),又进一步增强FOXA1募集。而在TET1耗尽后,FOXA1结合显著减少。本研究结果表明,FOXA1不仅能识别而且能够改变谱系特异性增强子的表观遗传特征,这种改变至少有部分是由FOXA1和TET1之间的前馈调节环介导的。。
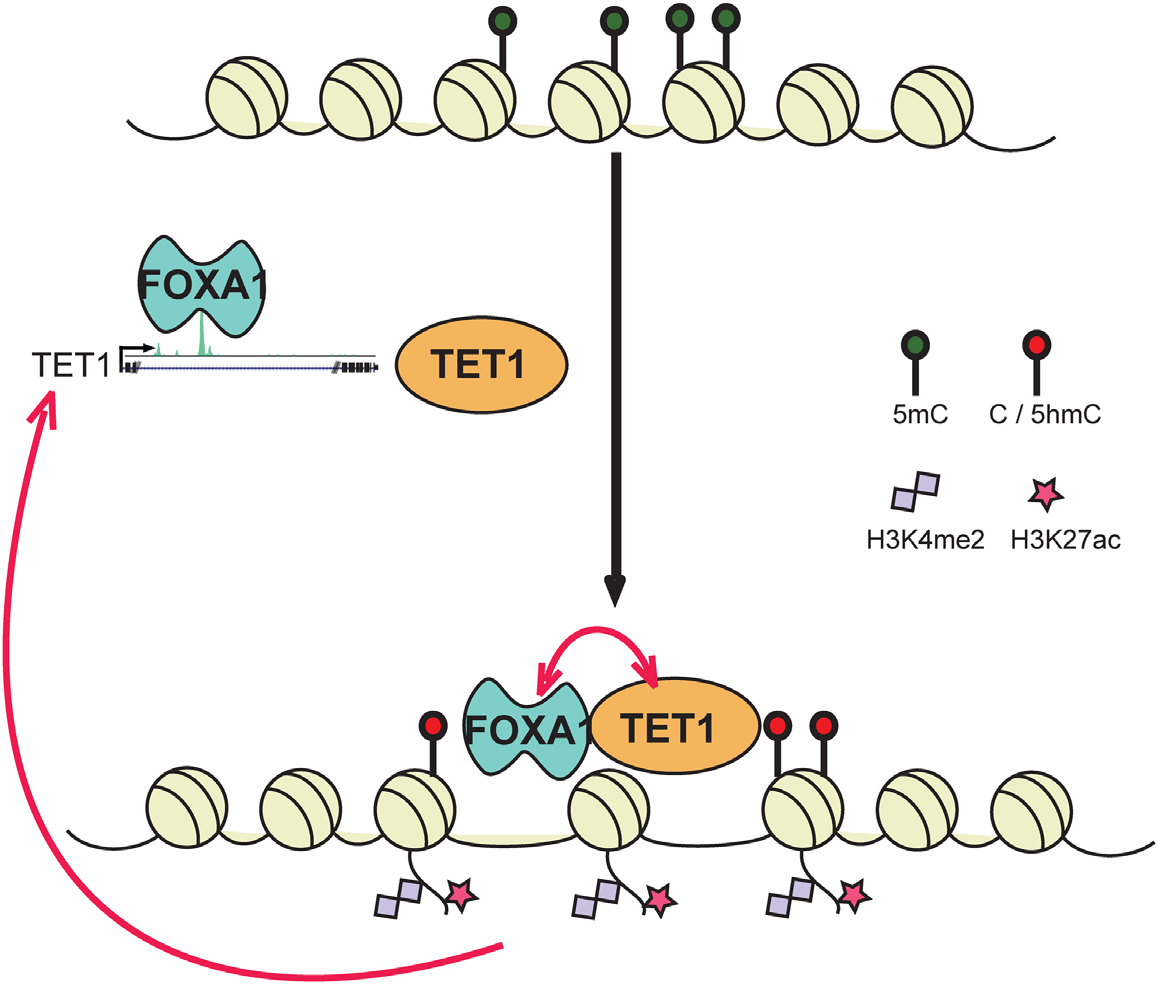
图1 FOXA1诱导TET1表达并与之互作调控增强子的表观修饰
为了确定FOXA1和活性增强子标记之间的相关性,作者重新分析了先前发表的对照组和FOXA1敲低组的FOXA1,H3K4me2和H3K27ac ChIP-seq数据,以及进行了MeDIP和hMe-Seal的高通量测序分析确认FOXA1结合位点(FXBS)确实富含 H3K4me2和H3K27ac(图2A), 并且虽然所有FOXA1占据位点周围5mC的平均强度在FOXA1敲低时没有受到很大影响(图2B),但5hmC显着下降(图2C),
而以FOXA1峰下游20kb的基因组区域(在本文中称为非峰位点)作为阴性对照的量度,没有表现出任何明显的模式(图2A:底部,图2D和E)。考虑到5hmC丰度仅占胚胎干细胞中5mC的大约10%,在5hmC比5mC中观察到更显着的变化是合理的。随后的MeDIP和hMe-Seal对各个FXBS基因进行qPCR,在许多FXBS中,FOXA1敲低后5hmC大大降低(图2F)。从这些结果可以推断,FOXA1可以在其占据的区域特异性地改变DNA甲基化以实现去甲基化状态,同时积累5hmC标记,从而增加增强子活化。
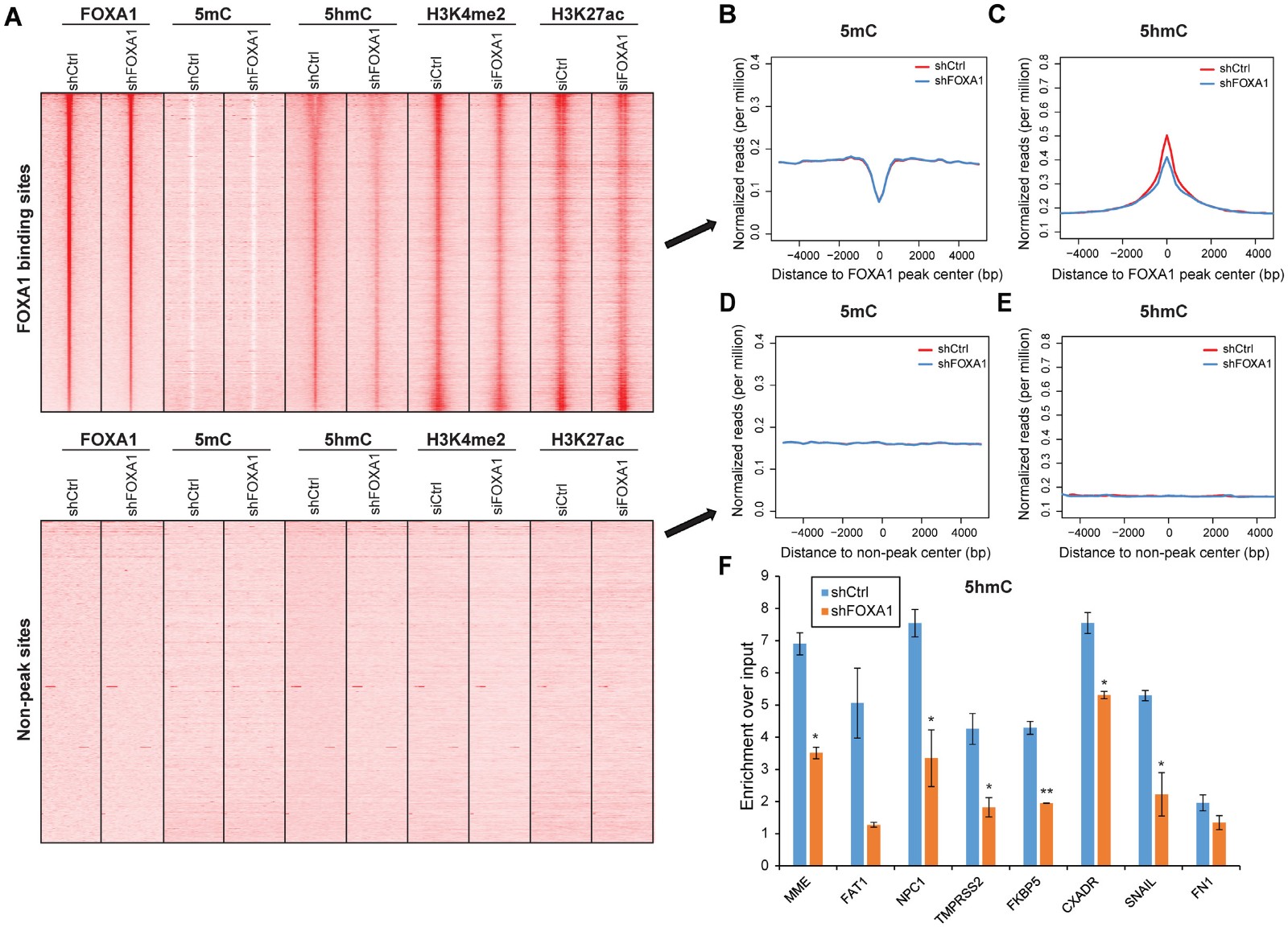
图2 FOXA1通过表观遗传修饰促进增强子活化。
A ChIP-seq、MeDIP和hMe-Seal高通量测序分析的热图呈现FXBS位点H3K4me2、H3K27ac、5hmC和5mC的富集;
B和C 显示的所有FXBS周围(A上)5mC(B)和5hmC(C)富集的平均强度图;
D和E 显示的所有非峰位点周围(A下)5mC(D)和5hmC(E)富集的平均强度图;
F 在对照和shFOXA1 LNCaP细胞对hMe-Seal进行的代表性FXBS基因Qpcr检测5hmC特异性变化。
(1)FOXA1正调控TET1的表达
由于TET蛋白催化的DNA去甲基化,作者接下来检测TET基因表达是否与FOXA1相关。首先在一组12个前列腺细胞系中对FOXA1和TET1转录物进行qRT-PCR分析,结果表明TET1与FOXA1的表达趋势相似(图3A,B)。那么FOXA1是否调节TET1基因表达?为了测试这一点,首先检测了对照或FOXA1敲低的LNCaP细胞中的TET1水平,在FOXA1敲低后LNCaP细胞中TET1转录物和蛋白质水平均显着降低(图3C,D),同时,另一种独立的前列腺癌细胞系C4-2B中FOXA1的消耗也导致TET1表达的降低(图3E)。另一方面,当FOXA1在22Rv1和DU145细胞中过表达时,TET1表达增强(图3F,G)。为了在细胞水平上可视化FOXA1对TET1的诱导作用,进行了免疫荧光染色。在用空载体对照的DU145细胞中几乎检测不到TET1,在用腺病毒FOXA1感染(Flag标记,显示为红色)时,TET1染色(以绿色显示)显着增强(图3H)。这些数据支持FOXA1正调节TET1基因的表达。
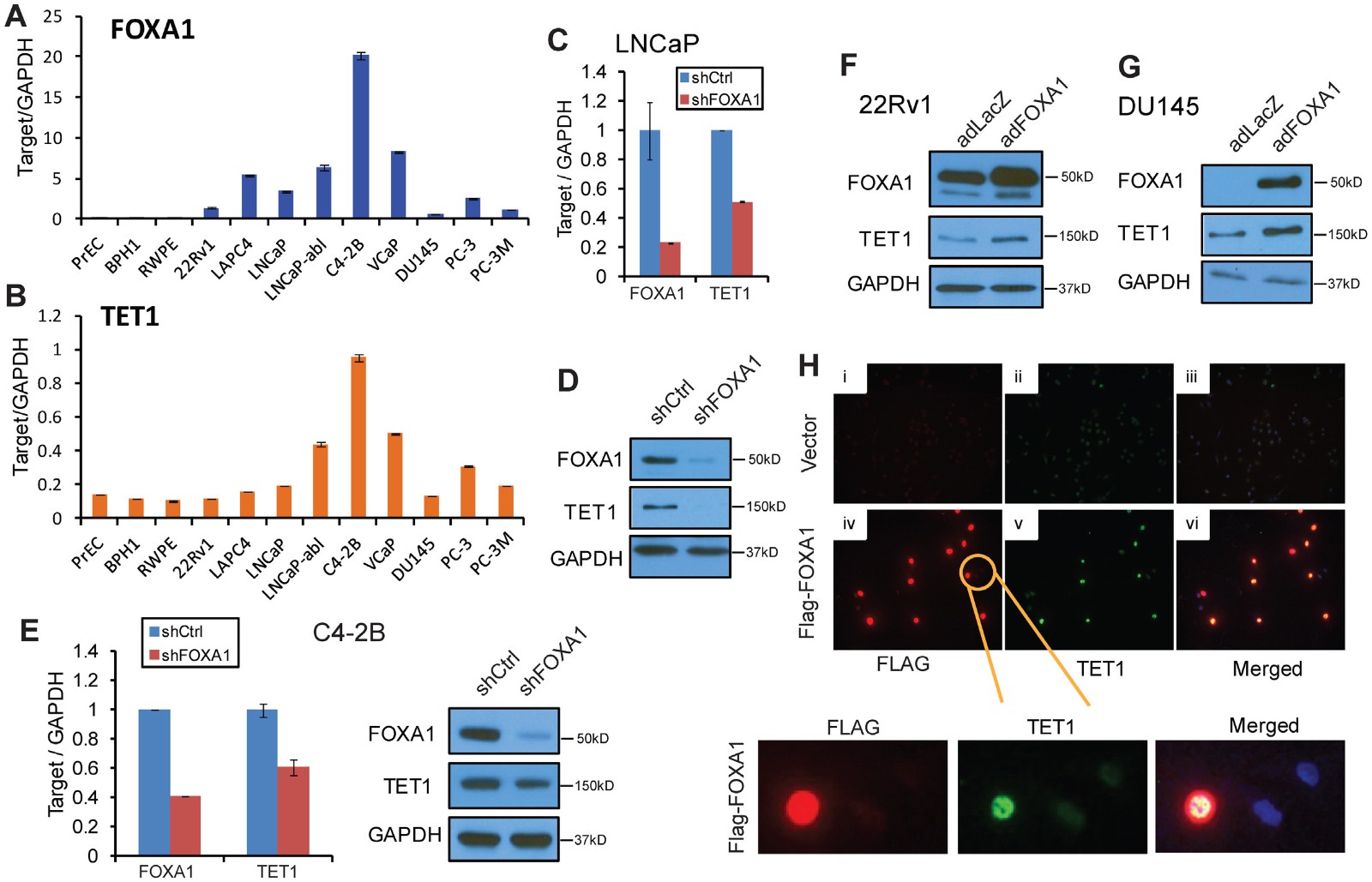
图3 FOXA1诱导TET1表达
A和B q-pcr检测12个前列腺细胞系的FOXA1和TET1基因的表达
C和D 分别q-pcr和WB检测LNCaP细胞系中FOXA1敲低对TET1表达的影响
E 分别q-pcr和WB检测C4-2B细胞系中FOXA1敲低对TET1表达的影响
F和G WB检测22Rv1和DU145细胞系中FOXA1过表达对TET1表达的影响
H 免疫荧光检测FOXA1表达对TET1表达的影响
(2)TET1基因是FOXA1的直接靶标
为了确定FOXA1如何转录控制TET1表达,作者分析了先前从LNCaP细胞获得的FOXA1 ChIP-seq数据,并在TET1基因的外显子区域内,即外显子3和4之间观察到强烈的FOXA1结合(图4A)。与FOXA1通过增强子-启动子环化调节靶基因的增强子一致,作者还在TET1启动子处发现了弱的FOXA1结合。为了验证ChIP-seq的结果,进行了ChIP-qPCR,发现FOXA1在TET1增强子中相对于IgG对照富集了近170倍,并且在TET1启动子处约10倍(图4B),富集水平与前列腺特异性抗原基因增强子(PSA)相当。此外,在敲低后,富集水平大大减少(图4C)。接下来,为了检查TET1增强子和启动子处的FOXA1占据是否导致其转录活性的调节,作者将这些区域克隆到荧光素酶报道构建体中。荧光素酶测定显示FOXA1过表达确实显着增加而FOXA1敲低减少TET1增强子和启动子活性(图4D和E)。为了进一步证明该调节是由于TET1增强子和启动子的FOXA1占据,对TET1增强子和启动子内FKHD基序的FOXA1结合峰周围的DNA进行突变测定,荧光素酶测定显示FKHD基序的突变消除了TET1增强子的FOXA1调节以及启动子活性(图4F)。这些数据支持FOXA1直接结合TET1的调控元件以诱导其转录。
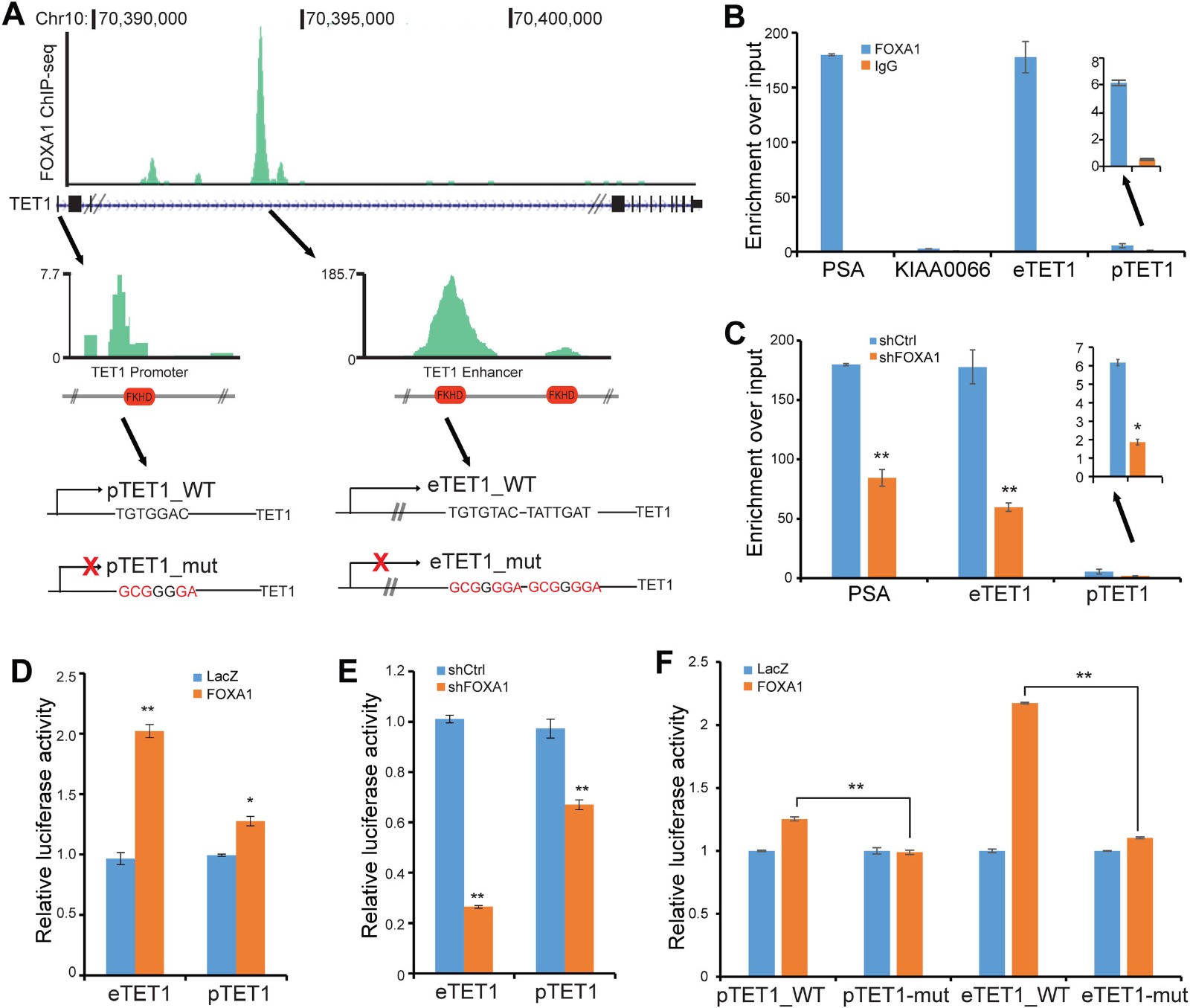
图4 FOXA1结合到增强子和启动子诱导TET1表达
A CHIP-seq数据分析表明FOXA1在TET1基因的启动子和增强子区域富集;
B和C CHIP-QPCR验证FOXA1在TET1启动子和增强子区域的富集;
D和E 荧光素酶实验验证FOXA1对TET1启动子和增强子活性的影响;
F 对TET1启动子和增强子区域FOXA1结合位点突变后的荧光素酶实验验证。
(1)FOXA1的FH结构域与TET1的CXXC结构域互作
由于FOXA1有助于局部DNA去甲基化(图2),TET1是已知的DNA去甲基化酶,作者假设TET1的作用可能归因于FXBS周围的DNA去甲基化。为了验证这一假设,作者研究了FOXA1和TET1蛋白之间的潜在相互作用。首先用Flag标记的TET1和FOXA1或空载体共转染293T细胞使用抗FOXA1抗体进行CO-IP,确认FOXA1能将TET1蛋白拉下(图5A),然后将TET1克隆到SFB标记的表达载体中,这使得能够使用S-蛋白琼脂糖珠下拉TET1蛋白并通过抗Flag抗体检测,CO-IP结果表明TET1蛋白能拉下FOXA1(图5B)。图5C则是直接的用蛋白本身的抗体相互IP证明两者具有细胞内源性互作。为了进一步确定与FOXA1的互作的TET1蛋白结构域,作者构建了四个Myc标记的TET1结构域构载体,即N末端,CXXC,中间和CD结构域,与用SFB标记的FOXA1共转染到293T细胞中。S-pull down下拉的WB显示仅含有CXXC模块的TET1片段能够结合FOXA1(图5D)。另一方面,为了找出与TET1蛋白互作的FOXA1结构域。类似地,构建了三个Flag标记的FOXA1结构域构建体,即N-末端,Forkhead(FH)和C-末端结构域,其与SFB标记的TET1-CXXC结构域共转染到293T细胞中然后进行S-pull down的WB检测,结果显示FOXA1的FH结构域与TET1的CXXC结构域互作(图5E)。
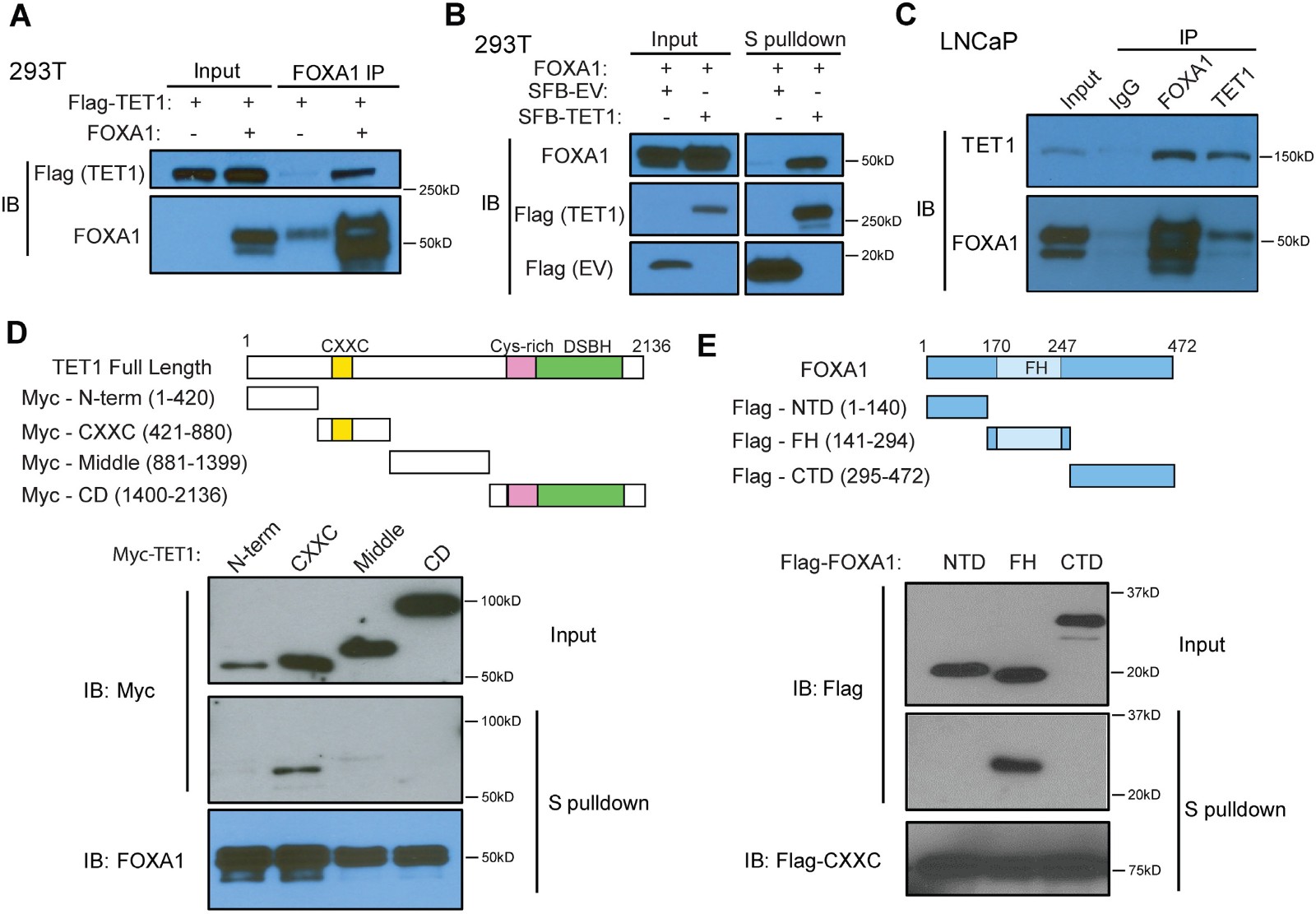
图5 FOXA1与TET互作
A-C CO-IP验证FOXA1与TET1的互作关系
D CO-IP检测与FOXA1结合的TET1结构域为CXXC
E CO-IP检测与TET1结构域CXXC结合的FOXA1结构域为FH
(2)TET1介导FOXA1依赖性增强子的表观遗传激活
为了确定TET1是否影响FOXA1占据的增强子的表观遗传修饰,首先测试TET1是否能够共同占据FOXA1结合的基因组区域。通过ChIP-qPCR表明在表达HA-TET1的细胞中比在用HA-对照载体转染的细胞中FXBS富集更强的HA(TET1)富集(图6A)。接下来,为了检测TET1如何改变这些FOXA1结合区域周围的DNA甲基化,shRNA进行了TET1敲低(图6B)。然后通过hMe-Seal-seq检测5hmCTET1敲低后总5hmC富集区域显着减少(图6C)和MeDIP-seq检测5mC显示增加了近33%(图6D)。所有峰的平均强度视图显示hMe-Seal信号显着降低,而MeDIP信号在TET1敲低后增加(图6E)。围绕FXBS的基因增强子表观遗传修饰的分析在TET1耗尽后总体减少5hmC和增加5mC,表明TET1对于维持这些增强子的去甲基化状态是关键的(图6F和G)。由于已显示DNA甲基化抑制增强子激活,接下来检测TET1敲低是否阻止FXBS的增强子激活。ChIP-qPCR显示在TET1耗尽后H3K4me2和H3K27ac确实均显着降低(图6H和1)。进一步ChIP-seq证实了TET1敲低中H3K4me2水平的全局下降(图6J)。这些数据支持TET1表达通过介导活性DNA去甲基化促进FOXA1-靶标增强子的活化。
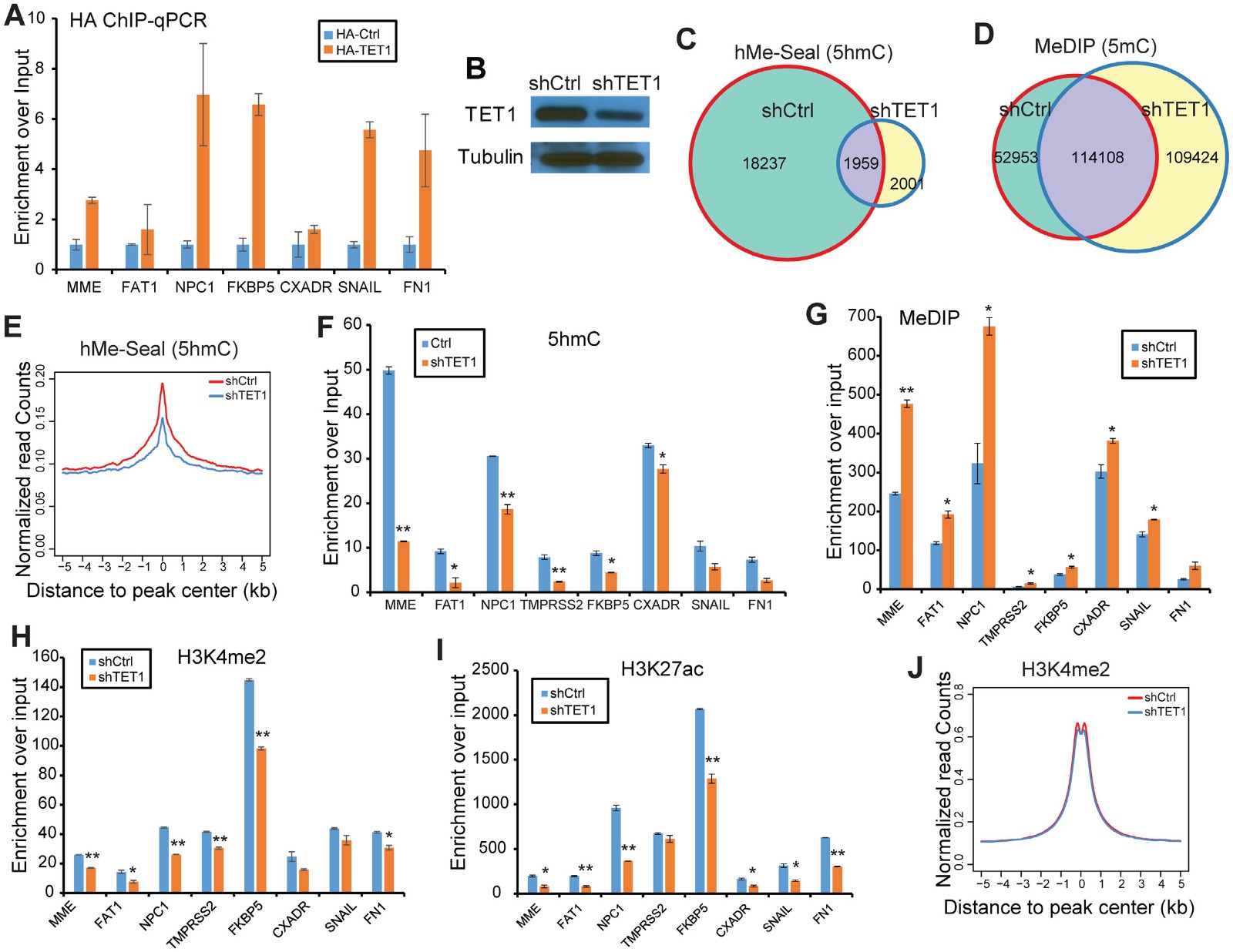
图6 TET1表达通过介导活性DNA去甲基化促进FOXA1-靶标增强子的活化
A HA-TET1 CHIP-QPCR检测表明TET1在FXBS位点富集
B WB检测TET1敲低效果
C hMe-Seal和MeDIP-seq数据分析表明TET1敲低后5hmC显著降低5mC增加
E hMe-Seal平均强度视图
F-G hMe-Seal和MeDIP-seq数据分析聚焦于FXBS位点
H-I CHIP-QPCR检测FXBS位点的H3K4me2和H3K27ac的富集表明TET1敲低后FXBS位点富集降低
J ChIP-seq证实TET1敲低中H3K4me2水平的全局下降
报道DNA甲基化和H3K4me2去除可能损害FOXA1结合,在TET1耗尽后观察到的DNA甲基化和组蛋白修饰的变化提示FOXA1向这些区域的富集被破坏。为了测试这一点,作者在对照和TET1敲低LNCaP细胞中进行FOXA1 ChIP-seq以确定TET1消耗是否能够调节FOXA1染色质靶标。结果显示在TET1敲低时,FOXA1结合能力显著降低(图7A)。此外,即使对于TET1敲低后未完全消除的位点(即共享位点),FOXA1结合的平均强度似乎也弱得多(图7B)。几种依赖于FOXA1的增强子的基因组视图进一步说明了TET1耗尽细胞中FOXA1占据的显着丧失(图7C和D)。同时,这些增强子的DNA甲基化增加,即5mC增加但5hmC信号减少,而活性增强子标记H3K4me2减少,与全基因组切换到抑制性染色质状态一致。此外,ChIP-qPCR证实TET1敲低显着降低多个靶标增强子的FOXA1占有率(图7E)。由于TET1通过其CXXC结构域与FOXA1蛋白相互作用但通过其CD结构域进行酶活性,我们接下来试图从机理上理解CD介导的DNA去甲基化是否足够促进FOXA1招募到靶标增强子。为了测试这一点,作者用TET1敲低在LNCaP细胞中过表达CD结构域。 ChIP-qPCR确认TET1敲低使靶向增强子的FOXA1结合降低,重要的是,可以通过伴随的CD结构域过表达完全挽救(图7F)。这些数据支持TET1通过活性去甲基化促进FOXA1募集到靶标增强子
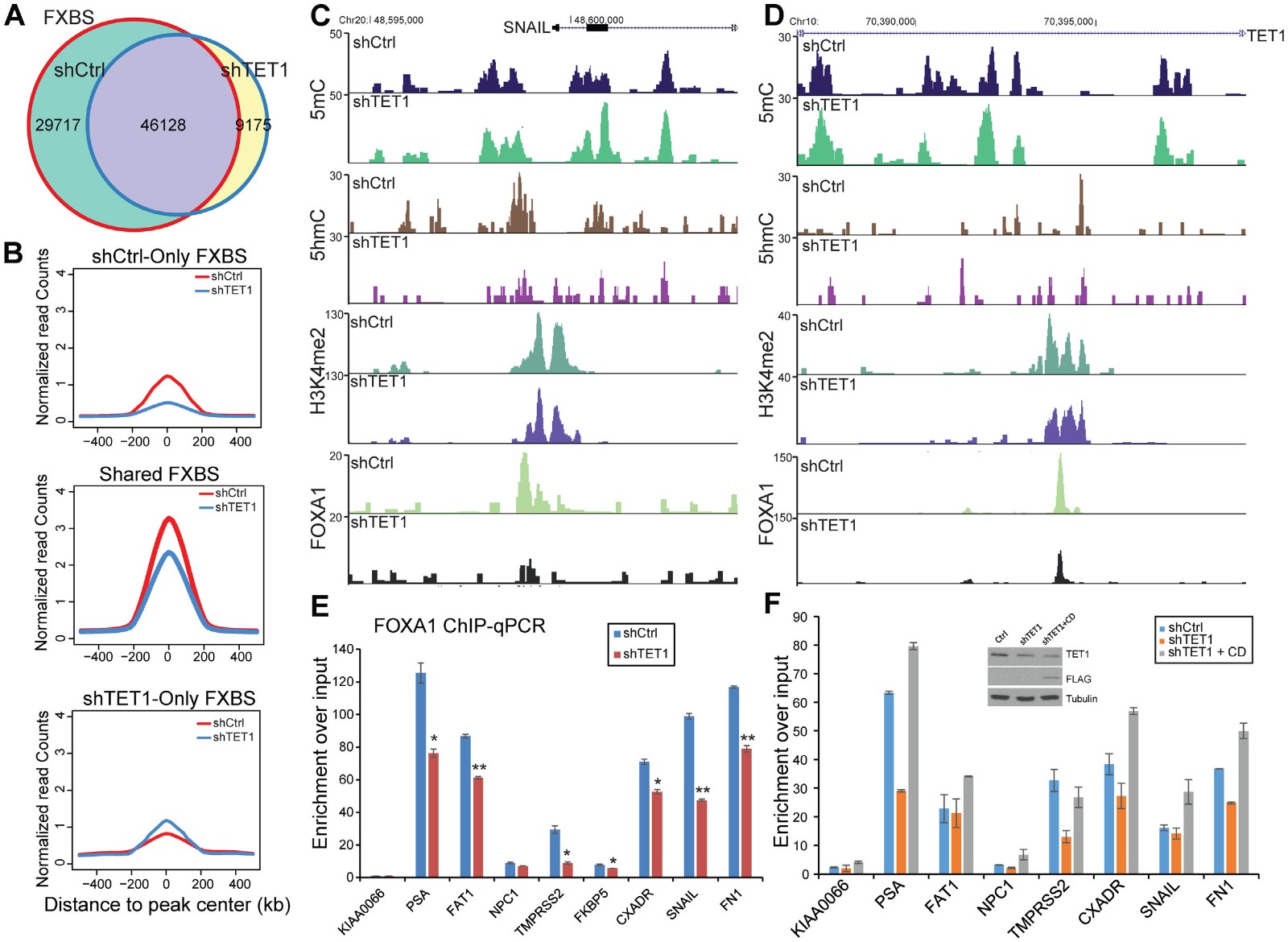
图7 TET1通过活性去甲基化促进FOXA1募集到靶标增强子
A-B CHIP-SEQ统计FOXA1富集量表明TET1敲低后FXBS位点显著降低
C-D SEQ视图显示TET1耗尽FOXA1占据靶标降低,活性增强子标记H3K4me2减少,5mC增加但5hmC信号减少
E ChIP-qPCR证实TET1敲低显着降低多个靶标增强子的FOXA1占有率
F ChIP-qPCR确认TET1敲低使靶向增强子的FOXA1结合降低,重要的是,可以通过伴随的CD结构域过表达完全挽救
最新DNA甲基化修饰:
- DNA甲基化文献赏析之三: TET酶通过对Aicda超级增强子上的5-hmC修饰增强活化诱导的脱氨酶(AID)表达
- DNA甲基化文献赏析之二: DNA甲基化维持障碍是胚胎干细胞全局去甲基化的主要原因
- Dicer promotes tumorigenesis by translocating to nucleus to promote SFRP1 promoter methylation in cholangiocarcinoma cells
- Epigenetic silencing of microRNA-137 enhances ASCT2 expression and tumor glutamine metabolism
- Transcriptional and Epigenetic Regulation of KIF14 Overexpression in Ovarian Cancer
