
广州市黄埔区学大道揽月路广州企业孵化器B座402
电话:020-85625352
手机:18102256923、18102253682
Email:servers@gzscbio.com
Fax:020-85625352
QQ:386244141
3D基因组学:一个崭新的领域
日期:2018-11-15 标签:3D基因组,TAD
前言
基因组是生命体完整的遗传信息。而基因组学则是研究基因组结构、功能与进化的学科。自上世纪八九十年代以来,随着技术的发展,基因组学取得长足发展:从过去获得核酸的序列,到如今对序列功能的描绘。
生物学中有一个基本观点:结构与功能相适应。尽管提到核酸链的结构,绝大多数人的第一反应是“双螺旋”模型,但是,基因组的物理结构,却远比双螺旋来得复杂——核酸链会在蛋白质的辅助下,形成更加高级的结构。这也催生了基因组学中一门子学科的诞生:三维(3D)基因组学。
倘若仅是回望基因组学本身的发展历程——从1977年首个生物基因组噬菌体φX174序列被测定,到2003年人类基因组计划完成,再到2012年ENCODE计划完成——还不足以代表人类解读生命遗传奥秘的历史。我们更应该回顾和基因组学不分家的遗传学之发展历程。
高中的生物学课堂就已经学到,Gregor Johann Mendel(孟德尔)是遗传学的奠基人,他的“豌豆杂交实验”(1856-1863年),依然是中学生物考题的常用材料。随后,对孟德尔由路转粉的Thomas Hunt Morgan(摩尔根)利用果蝇的突变体,首次确认基因位于染色体上,提出“连锁互换定律”,成为了现代遗传学的奠基人(1908-1915;摩尔根的贡献非常多,这个时间段只是一个粗略的标记)。
对如今的我们来说,不难理解DNA与RNA是携带遗传信息的物质。不过在上世纪中期以前,世人还认为蛋白质才是遗传物质。1928年,Frederick Griffith(格里菲斯)的“肺炎双球菌转化实验”,提出了转化因子学说。但直到1944年,Oswald Avery、Colin MacLeod和Maclyn McCarty三人通过比较蛋白质、多糖与DNA等的转化效应,才逐渐树立了DNA是遗传物质的地位。到了1952年,Alfred Hershey与Martha Chase利用同位素分别标记蛋白质和DNA,最终确认了DNA是遗传物质。
早在DNA发现之初(1869年,Friedrich Miescher),科学家便展开了对其物理结构的鉴定。但一直到1953年,才由James Watson和Francis Crick阐明了DNA的双螺旋结构。
真核生物的基因组含有大量的结合蛋白,包括组蛋白。在原核生物中,也有组蛋白样的DNA结合蛋白。1974-1976年间,科学家首次获得DNA缠绕在组蛋白上的电镜照片(Science. 1974 Jan 25;183(4122):330-2.,Exp Cell Res. 1976 Jan;97:101-10.),并最终在1997年获得结晶结构(Nature. 1997 Sep 18;389(6648):251-60.)。
DNA-组蛋白这种beads on a string“串珠式”的结构,能够显著缩短DNA链在一维水平的尺度,大概7倍。形象一些,对于人类全部DNA而言,将DNA链线性展开,能得到约为2米的长链,再经串珠式压缩,也还有约29厘米。显然,这对于袖珍的细胞核来说,这种结构依然太大了。对染色体的形态观察也提示,DNA与结合蛋白一定形成了更加高级的结构。
2005年,Timothy J. Richmond团队首次报道了chromatin fiber(染色质纤维)的结构。2014年,中国科学家Ping Zhu和Guohong Li小组得到了更加精确的染色质纤维结构。他们的研究都证明,DNA-组蛋白的串珠式结构,还会进一步被压缩成直径仅有30纳米的纤维结构。而在目前的理论模型中,这些染色质纤维还会在包括Cohesin、CTCF等蛋白的帮助之下,扭曲成环,形成更加复杂的结构,最终被压缩成染色体。
讲了半天历史,目的是为了让各位读者能够得到这样一个基本认识:生命体的遗传功能元件,包括编码基因、非编码基因、顺式调控元件等,在空间结构上,并不是在染色体上呈线性地一字依次排开,而是随着DNA形成复杂高级结构的同时,具备了三维组织形式。
为了加深印象,我们不妨再来看下方另外一幅染色体结构的卡通。简而言之,DNA双链就跟纠缠在一起的电话线一般,一圈圈地绕行、压缩,最终形成了染色体。也正因为有这种绕圈圈的压缩方式,我们不难想象,DNA能够密密麻麻地形成许多环状结构。这些环状结构还能再继续绕圈压缩下去。
换句话说,在DNA一维层面上相隔比较远的区域,反而有可能靠得更近。比方说下图中的ABCD四个点,若以A为参照物,C比B远,但由于基因组形成了高级结构,反而把A和C拉得更近。这个示意图还提示了另外一个问题,即同一条染色体上的某些区域,可能很难互相接触,比如B和D之间就,被环状结构给隔开了。
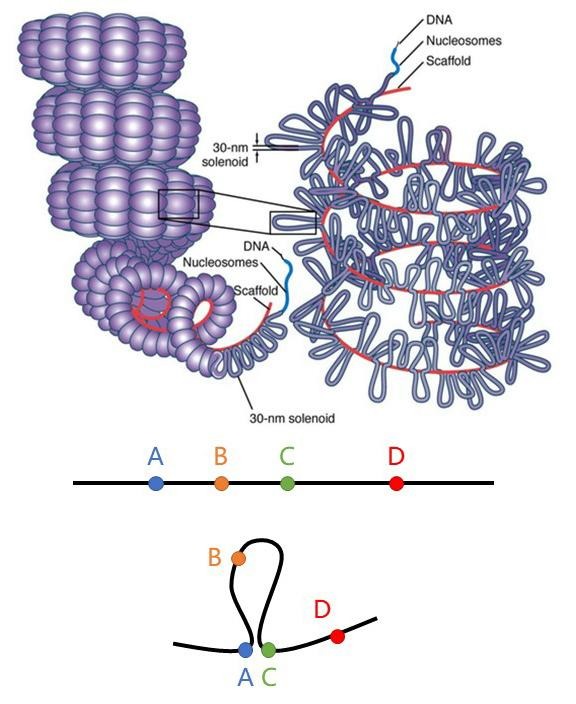
DNA这种相对稳定的高级结构,是由蛋白质来维持的。这同时也为破解基因组的三维结构奠定了技术基础。我们再来利用上面那个ABCD四个小点的图来理解这一项技术。假如说,A和C是帮助DNA凹造型的蛋白,并且它们靠得很近,甚至有蛋白-蛋白相互作用。这时,我们使用甲醛等交联剂,就可以把DNA-结合蛋白以及他们之间形成的高级结构给固定下来。但这种复合物体积非常庞大,为了方便测序建文库,我们需要将DNA利用超声或限制性内切酶打碎。这时候我们得到的,就是许许多多由蛋白质紧紧锁住的包含缺口的小结构。我们再用酶把这些断裂的DNA给修复回去,就会得到许多能够发生相互作用的、具备环状结构DNA了。最后,我们再通过测序的方法就能发现,原本中间隔了个B的A和C位点,居然靠到一起,而C和D虽然很靠近,但却可能测不到它们在一起。
上面所述的方法,便是染色质构象捕获(Chromatin Conformation Capture)技术。大致的流程,可以看下面的图片。最早的技术路线(简称3C,源自英文名首字母),只能研究一个位点对另外一个位点的相互作用(一对一)。而后又发展出了4C(一对全),5C(多对多),Hi-C(全对全),Capture-C(多重一对一)等技术。只是随着复杂度的提高,分辨率也会降低。相关综述可以看这篇文章Unraveling the 3D genome: genomics tools for multi-scale exploration,这里就不详述了。
通过构象捕获技术,从全基因组的角度而言,科学家都得到了什么样的发现呢?
许多小组都发现了一个共同现象:如下图所示,基因组的相互作用,因其三维的物理结构,形成了许多分区。为了读懂这个图,我们需要先理解它是如何绘制。假设线性的染色体座位的蓝、橙、绿三点之间能够发生相互作用,我们就用线段把它们连起来,形成一个等腰三角形,并在线段的交叉点,用颜色的深浅,来代表相互作用的频率,或者说强度。
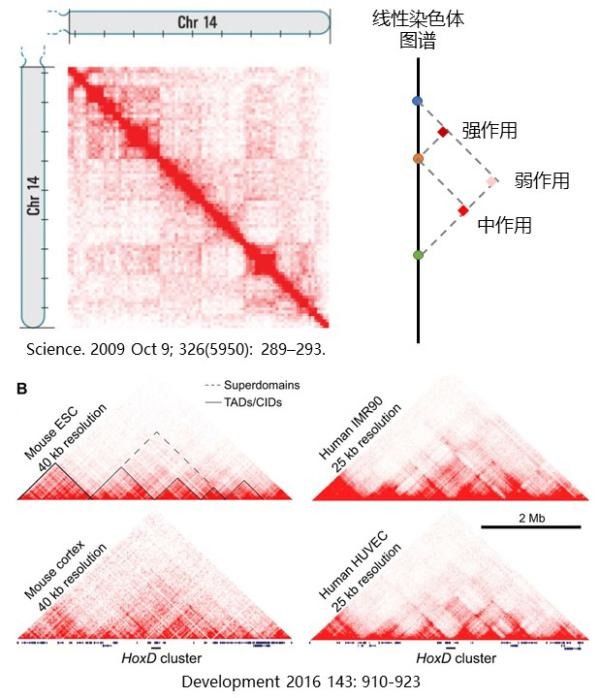
通过这种方法作图,可以得到许多三角形结构,密集排布在染色体之上。有些小的三角形,颜色比较深,代表着这个三角形内部的相互作用更频繁,同时它们之间甚至有些“泾渭分明”地相邻排布,即甚少与相邻区域发生相互作用,从而形成不同的结构域。科学家将这样的结构域称为Topologically Associating Domain(TAD,中文名姑且翻译为“拓扑相关结构域”)。但又不是说,小结构域之间就绝对不会发生相互作用了,只是频率会比较低。数个相邻且又能发生相互作用的TAD,就形成了Superdomain(超结构域)。随着在染色体上的物理距离增大,相互作用的频率会呈负指数式降低。
TAD里面会是些什么东西呢?
在哺乳动物基因组中,TAD通常由CTCF这个转录抑制因子给分割开来。CTCF还会和Cohesin蛋白复合物结合,帮助基因组形成相对稳定的三维结构。正由于此,两个TAD之间的转录活性是非常低的(转录需要打开DNA),而结合CTCF等转录抑制因子的DNA元件,也被称为insulator(绝缘子)。
不过,在TAD内部可就热闹了。CTCF在帮助基因组DNA凹造型的同时,就把线性展开时距离较远的DNA元件给绑到了一起。而这样相互作用的元件,通常是enhancer(增强子)和promoter(启动子)。
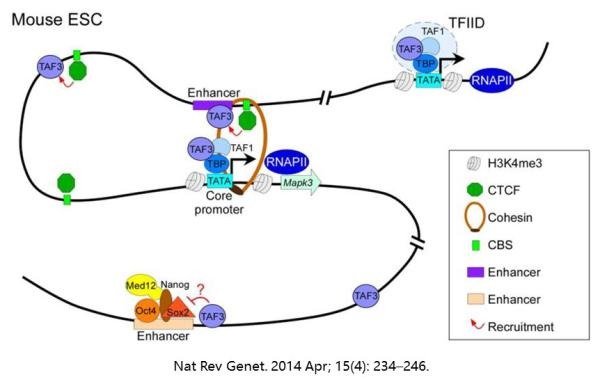
这样做有两个好处。一是缩短了enhancer和promoter之间的空间距离,增强了基因的转录。二是给调控元件合理分区,使得基因转录在不同发育阶段、不同生理条件下,受到特定enhancer的调控。比方说,在胚胎发育早期,干细胞那套基因的表达会占主导。随着发育的进行,表达模式会逐渐替换成特定lineage的基因,再到成熟细胞的基因。倘若没有这样的动态调整的三维分区,这种基因的空间与时序性表达机制,估计就很难实现了。
当然,这里并不是在表达一种设计论的观点。这种精致的调控机制,是在漫长的进化过程中,逐渐选择、适应的结果。
TAD除了形成相对稳定的遗传信息表达功能结构之外,还有其他重要的生物学意义。比如它同样也是细胞周期S期时,DNA复制的结构单元。在不久的将来,科学家还将发现更多的三维基因组功能。
读到这里,我想各位读者应该不难理解,假设基因组的三维结构出了差错,后果可是相当严重。这里本司机举两个例子来说明。
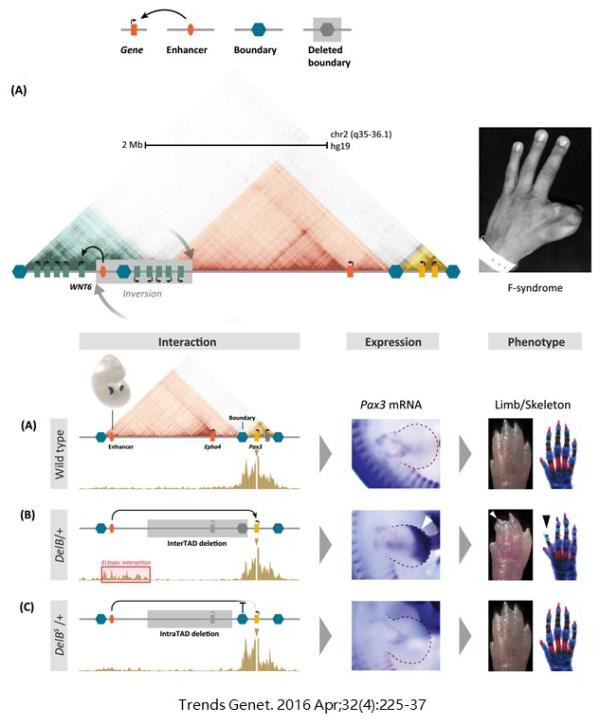
首先,维系正常的基因组三维结构,对保持正常的发育进程有重要的意义。早有文献通过经典的遗传学方法,将F syndrome(表现为手指、脚趾、腭和胸骨发育异常)这种遗传疾病定位到了染色体2q36处。这个区域含有对发育具有重要意义的IHH、WNT6A、WNT10A、PAX3和STK36等基因。如下图所示,最近的研究证明,在有些F syndrome的病例中,WNT6A基因所在的TAD边界染色体区域发生了翻转,使得相邻TAD的增强子跑到WNT6A所在的TAD之中,导致WNT6A异常表达。在小鼠模型中,用CRISPR敲除PAX3基因所在TAD的边界,同样会导致相邻TAD的增强子跑过来调控PAX3,使其表达量异常升高,造成小鼠指骨发育异常。与此对照,用CRISPR敲除相邻TAD内部的序列,不碰及PAX3所在TAD的边缘,PAX3基因的表达水平就不会异常升高,也不会有发育异常现象
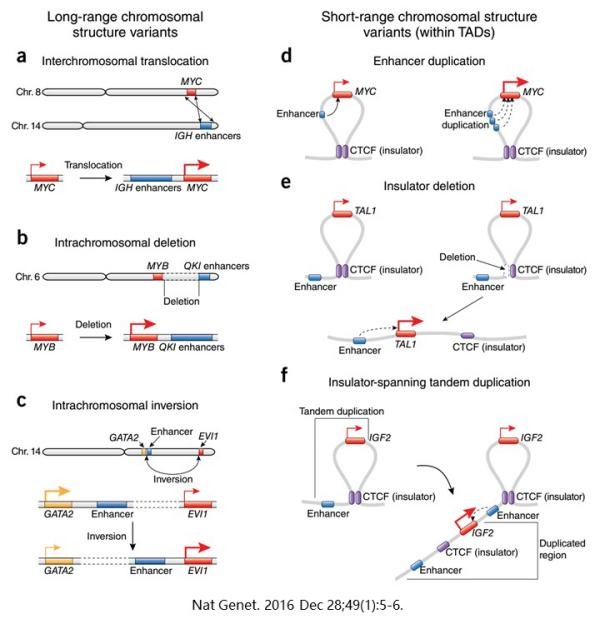
第二个例子来自于癌症。肿瘤细胞的基因组是非常混乱的,有许多扩增、缺失和易位。拿原癌基因为例,它的高表达可以来自于原癌基因本身的拷贝数增加,也可以是其表达调控机制得到了增强。这篇综述(Copy number alterations unmasked as enhancer hijackers.)为我们详解,非编码区域拷贝数的异常,是如何导致原癌基因的过度表达的。比如说,MYC基因座位的易位,导致它跑到一个IGH增强子附近(a)。MYB基因附近的染色体区域缺失,把远处的QKI增强子给带到它身边(b)。TAL1所在TAD边缘的染色体区域缺失,导致相邻增强子越俎代庖(e)。IGF2基因座位跨TAD的倍增,导致原本不能调控IGF2的、来自隔壁TAD的增强子,推动了IGF2的表达(f)。其他的机制,就请读者自行读图。而这种现象,科学家将其命名为enhancer hijacking(增强子绑架)。
结语
自孟德尔以来,遗传学与基因组学的历史不过百余年。但也就在这百余年中,这两个领域的发展如同其他生物学学科一般,可谓突飞猛进。对80后而言,我们在中学课堂方才学到人类基因组计划,但转眼之间,基因组学就进入了3D的时代。而在六七十年前,人类甚至还搞不清楚DNA是一种遗传物质。
虽然研究基因组三维结构的染色质构象捕获技术3C早在2002年就诞生了,但直到近年更高复杂度的捕获技术的出现,3D基因组领域才变得火热起来。毫无疑问,3D基因组学也面临着和经典基因组学同样的挑战:如何将结构与功能联系起来。在不久的将来,科学家们还必须回答另外一个问题,即如何结合3D基因组学的成果,用于治疗人类疾病。
